L’acido benzoico è un solido cristallino incolore utilizzato come conservante alimentare e come precursore di molti altri composti organici. Può essere sintetizzato da toluene o benzene.
| Nome IUPAC | Acido benzoico |
| Formula molecolare | C7H6O2 |
| numero CAS | 65-85-0 |
| Sinonimi | Carbossibenzene, acido benzeneformico, acido fenilformico, acido benzencarbossilico, E210 |
| InChI | InChI=1S/C7H6O2/c8-7(9)6-4-2-1-3-5-6/h1-5H,(H,8,9) |
Massa molare dell’acido benzoico
L’acido benzoico ha una massa molare di 122,12 g/mol. È un composto organico semplice costituito da un anello benzenico attaccato a un gruppo funzionale di acido carbossilico. La massa molare si calcola sommando le masse atomiche di tutti gli atomi presenti in una singola molecola del composto. Nel caso dell’acido benzoico la formula è C7H6O2, quindi la massa molare può essere calcolata come segue:
7(12,01) + 6(1,01) + 2(16,00) = 122,12 g/mol
Conoscere la massa molare è importante per determinare la quantità di acido benzoico necessaria per le reazioni chimiche e per calcolare altre proprietà come concentrazione e densità.
Struttura dell’acido benzoico
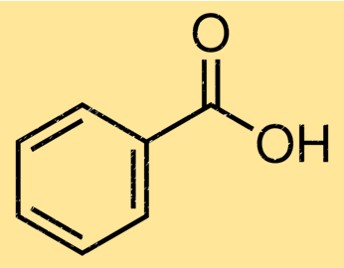
La struttura dell’acido benzoico è costituita da un anello benzenico attaccato a un gruppo funzionale dell’acido carbossilico. L’anello benzenico è un anello di carbonio a sei membri con doppi legami alternati, mentre il gruppo acido carbossilico è costituito da un atomo di carbonio doppiamente legato a un atomo di ossigeno e un singolo legame a un gruppo ossidrile. La struttura dell’acido benzoico è importante nel determinare le sue proprietà chimiche e fisiche.
Formula dell’acido benzoico
La formula chimica dell’acido benzoico è C7H6O2. Questa formula ci dice che ogni molecola di acido benzoico contiene sette atomi di carbonio, sei atomi di idrogeno e due atomi di ossigeno. La formula viene utilizzata per determinare la massa molare e il peso molecolare dell’acido benzoico, nonché il rapporto degli elementi presenti nel composto.
Punto di fusione dell’acido benzoico
L’acido benzoico ha un punto di fusione di 122,4°C. Questa è la temperatura alla quale la forma solida dell’acido benzoico inizia a sciogliersi e a trasformarsi in un liquido. Il punto di fusione è influenzato da fattori quali purezza, struttura cristallina e forze intermolecolari. L’acido benzoico ha un punto di fusione relativamente alto a causa delle sue forti forze intermolecolari, causate dai legami idrogeno tra i gruppi di acido carbossilico di molecole adiacenti.
Punto di ebollizione di BzOH
Il punto di ebollizione di BzOH è 249°C. Questa è la temperatura alla quale la forma liquida di BzOH inizia a vaporizzare e trasformarsi in un gas. Il punto di ebollizione di una sostanza è influenzato da fattori quali forze intermolecolari, pressione e presenza di impurità. BzOH ha un punto di ebollizione relativamente alto a causa delle sue forti forze intermolecolari, causate dai legami idrogeno tra i gruppi di acido carbossilico di molecole adiacenti.
Densità di BzOH g/ml
La densità di BzOH è 1,265 g/mL. Questa è la massa di un millilitro di BzOH a una temperatura e pressione specifiche. La densità è un’importante proprietà fisica utilizzata per determinare la massa di una sostanza in un dato volume. La densità di BzOH è influenzata da fattori quali temperatura e pressione.
Peso molecolare BzOH
Il peso molecolare di BzOH è 122,12 g/mol. Questa è la massa di una molecola di BzOH. Il peso molecolare viene utilizzato per determinare il numero di molecole in una data massa di una sostanza. Si calcola sommando le masse atomiche di tutti gli atomi della molecola.
| Aspetto | Cristalli bianchi |
| Peso specifico | 1.265 g/cm³ |
| Colore | Incolore |
| Odore | Debole, piacevole |
| Massa molare | 122,12 g/mole |
| Densità | 1.265 g/cm³ |
| Punto di fusione | 250°F |
| Punto di ebollizione | 249°C |
| Punto flash | 121°C |
| solubilità in acqua | 3,8 g/l |
| Solubilità | Solubile in etanolo, etere, benzene e cloroformio; leggermente solubile in acqua |
| Pressione del vapore | 0,00027 mmHg a 25°C |
| Densità del vapore | 4.2 (aria=1) |
| pKa | 4.2 |
| pH | 2.7 – 3.5 |
Sicurezza e pericoli dell’acido benzoico
L’acido benzoico (BzOH) può essere pericoloso se maneggiato in modo errato. È irritante per la pelle e gli occhi e può causare irritazione respiratoria se inalato in alte concentrazioni. L’ingestione di grandi quantità di BzOH può anche causare nausea, vomito e dolore addominale. Il composto è infiammabile e può accendersi se esposto a calore o fiamme. È importante maneggiare BzOH con cura, indossando dispositivi di protezione adeguati ed evitando il contatto con pelle, occhi e mucose. In caso di esposizione accidentale, le aree interessate devono essere risciacquate con acqua e, se necessario, consultare un medico. È inoltre necessario seguire adeguate procedure di stoccaggio e smaltimento per evitare la contaminazione ambientale.
| Simboli di pericolo | XI |
| Descrizione della sicurezza | Evitare il contatto con la pelle e gli occhi; Indossare guanti/occhiali protettivi; In caso di contatto con gli occhi, immediatamente abbondantemente con acqua e risciacquare un medico; Conservare in luogo asciutto, lontano da fonti di calore e materiali incompatibili; Tenere i contenitori ermeticamente chiusi. |
| Identificatori AN | ONU 3077 (ADR/RID), ONU 1220 (IMDG), ONU 3077 (ICAO) |
| Codice SA | 2916.31.00 |
| Classe di pericolo | 9 (Materiali e oggetti pericolosi vari) |
| Gruppo di imballaggio | III |
| Tossicità | L’acido benzoico è relativamente non tossico, con un LD50 orale nei ratti compreso tra 1700 e 1940 mg/kg. Può causare irritazione alla pelle e agli occhi, nonché irritazione respiratoria se inalato in alte concentrazioni. L’ingestione di grandi quantità può anche causare disturbi gastrointestinali. |
Metodi per la sintesi dell’acido benzoico
L’acido benzoico (BzOH) può essere sintetizzato con vari metodi.
Un metodo comune consiste nell’ossidare il toluene o il cloruro di benzile utilizzando permanganato di potassio o acido cromico. Un altro metodo prevede la reazione del benzene con anidride carbonica e un catalizzatore metallico, come ossido di rame o magnesio, in presenza di calore e pressione.
BzOH può essere ottenuto mediante idrolisi di benzamide, benzoil cloruro o benzotrifluoruro utilizzando una base forte, come l’idrossido di sodio. Questo processo produce BzOH e la corrispondente ammina o alcol. In alternativa, BzOH può essere ottenuto facendo reagire l’alcol benzilico con permanganato di potassio o dicromato di sodio.
Per sintetizzare BzOH è possibile utilizzare un reagente di Grignard, formato dalla reazione del magnesio e di un alogenuro alchilico o arilico, con l’anidride carbonica. Per convertire l’acido carbossilico risultante in BzOH, la soluzione può essere acidificata.
BzOH può essere prodotto ossidando il toluene in presenza di un catalizzatore di cobalto o manganese. Questo metodo è particolarmente utile per la produzione su larga scala.
Ciascuno di questi metodi di sintesi presenta vantaggi e svantaggi a seconda dell’applicazione specifica e della scala di produzione. È importante scegliere il metodo più appropriato in base a fattori quali costo, efficacia e impatto ambientale.
Usi dell’acido benzoico
- Le persone usano comunemente l’acido benzoico (BzOH) come conservante alimentare perché può inibire la crescita di batteri e funghi.
- I produttori lo utilizzano come intermedio nella sintesi di vari prodotti chimici, inclusi coloranti, profumi e prodotti farmaceutici.
- I produttori utilizzano BZOH nella produzione di plastificanti, come il benzil benzoato, che vengono utilizzati nella produzione di PVC e altre materie plastiche.
- Svolge un ruolo essenziale nella produzione di fenolo, utilizzato nella produzione di resine, adesivi e disinfettanti.
- I produttori aggiungono BZOH agli alimenti per animali domestici per prevenire la crescita di muffe e batteri.
- Agisce come precursore del perossido di benzoile, utilizzato nel trattamento dell’acne.
- I produttori utilizzano BZOH nella produzione di vari tipi di polimeri, tra cui poliestere, nylon e poliuretano.
- Le industrie lo utilizzano come solvente per vari composti organici, tra cui resine, oli e cere.
- I produttori utilizzano BZOH nella produzione di vari tipi di sali, come il benzoato di sodio, che vengono utilizzati come conservanti alimentari e agenti antimicrobici.
- BZOH viene utilizzato nella produzione di vari tipi di detersivi, inclusi detersivi per bucato, detersivi per piatti e detergenti.
Domande:
D: L’acido benzoico è solubile in acqua?
R: BzOH è scarsamente solubile in acqua, con una solubilità di 3,4 g/L a 25°C. Tuttavia, è più solubile in solventi organici come etanolo e acetone.
D: L’acido benzoico è un acido forte?
R: No, BzOH è un acido debole. In acqua si dissocia parzialmente per formare ioni idronio e ioni benzoato. La sua costante di dissociazione (Ka) è 6,5 x 10^-5, indicando la sua natura debole acida.
D: Una soluzione di acido benzoico 0,20 M (C6H5COOH) ha un pH di 2,45. Qual è Ka per l’acido benzoico?
R: La Ka di BzOH può essere calcolata utilizzando il pH della soluzione e la concentrazione dell’acido. Utilizzando il pH di 2,45 e l’equazione di dissociazione BzOH, si calcola che la Ka sia 6,5 x 10^-5.
D: L’acido benzoico è polare o non polare?
R: L’acido benzoico è una molecola polare a causa della presenza del gruppo funzionale dell’acido carbossilico, che contiene un atomo di ossigeno elettronegativo che crea un momento dipolare.
