L’acido acetico glaciale è una forma altamente concentrata di acido acetico, contenente tipicamente dal 99,5 al 100% di acido acetico. È un liquido incolore con un odore forte e pungente.
| Nome IUPAC | Acido acetico |
| Formula molecolare | C2H4O2 |
| numero CAS | 64-19-7 |
| Sinonimi | Acido acetico, acido etanolico, acido metancarbossilico, acido dell’aceto |
| InChI | InChI=1S/C2H4O2/c1-2(3)4/h1H3,(H,3,4) |
Proprietà dell’acido acetico
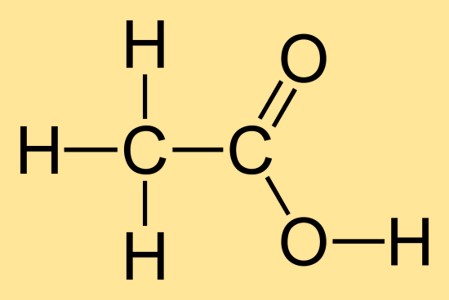
Massa molare dell’acido acetico glaciale
La massa molare dell’acido acetico glaciale è 60,05 g/mol. Ciò significa che una mole di acido acetico pesa 60,05 grammi. La massa molare si calcola sommando i pesi atomici di tutti gli atomi nella formula chimica, che in questo caso è C2H4O2.
Punto di ebollizione dell’acido acetico glaciale
Il punto di ebollizione dell’acido acetico è 118,1°C (244,58°F). Ciò significa che a questa temperatura l’acido acetico passa dallo stato liquido a quello gassoso. Il punto di ebollizione di una sostanza è influenzato da vari fattori come la pressione e le impurità, ma l’acido acetico ha un punto di ebollizione relativamente basso rispetto ad altri composti organici.
Punto di fusione dell’acido acetico glaciale
Il punto di fusione dell’acido acetico è 16,73°C e il punto di ebollizione normale è 117,9°C.
Densità dell’acido acetico glaciale g/ml
La densità dell’acido acetico è 1,049 g/ml. Ciò significa che un millilitro di acido acetico pesa 1.049 grammi. La densità di una sostanza è influenzata dalla sua temperatura e pressione, ma l’acido acetico è relativamente denso rispetto ad altri composti organici.
Peso molecolare dell’acido acetico glaciale
Il peso molecolare dell’acido acetico glaciale è 60,05 g/mol. Ciò significa che una mole di acido acetico pesa 60,05 grammi. Il peso molecolare di una sostanza è uguale alla sua massa molare e si calcola sommando i pesi atomici di tutti gli atomi presenti nella formula chimica. Nel caso dell’acido acetico, il peso molecolare è C2H4O2.
| Aspetto | Liquido limpido e incolore |
| Peso specifico | 1.049 (20°C) |
| Colore | Chiaro, incolore |
| Odore | Forte, pungente, simile all’aceto |
| Massa molare | 60.052 g/mole |
| Densità | 1,05 g/cm3 (20°C) |
| Punto di fusione | -16,6°C |
| Punto di ebollizione | 118,1°C |
| Punto flash | 16,1°C (tazza chiusa) |
| solubilità in acqua | Miscibile |
| Solubilità | Miscibile con la maggior parte dei solventi organici |
| Pressione del vapore | 40,5 kPa (20°C) |
| Densità del vapore | 2.02 (aria = 1) |
| PKa | 4.76 |
| PH | 2.4 (soluzione 1M) |
Sicurezza e pericoli dell’acido acetico glaciale
L’acido acetico è una sostanza altamente corrosiva e tossica che può causare gravi irritazioni alla pelle e agli occhi, ustioni chimiche e problemi respiratori se non maneggiata correttamente. Dovrebbe essere sempre maneggiato con guanti, occhiali e camice da laboratorio per proteggersi dal contatto con la pelle e gli occhi. Inoltre deve essere conservato in un luogo fresco e asciutto, lontano da fonti di calore e fiamme libere per evitare possibili esplosioni. È importante seguire sempre i protocolli di sicurezza adeguati e utilizzare i DPI corretti quando si maneggia l’acido acetico.
| Simbolo di pericolo | Corrosivo |
| Descrizione della sicurezza | Può causare gravi ustioni alla pelle e danni agli occhi |
| UN ID | UN2689 |
| Codice SA | 2915.11.00 |
| Classe di pericolo | 8 |
| Gruppo di imballaggio | II |
| Tossicità | Alto |
Metodi di produzione dell’acido acetico glaciale
L’acido acetico può essere preparato mediante ossidazione dell’etanolo o dell’acetaldeide. Il metodo più comune è l’ossidazione dell’etanolo utilizzando un catalizzatore come il cromite di rame. La reazione viene generalmente condotta ad alta temperatura (intorno a 200-250°C) e sotto elevata pressione di ossigeno. Il liquido risultante viene quindi distillato per separare l’acido acetico da qualsiasi residuo di etanolo o acqua. Un altro metodo è la carbonilazione del metanolo utilizzando un catalizzatore come il rodio, che produce acido acetico come sottoprodotto. Entrambi i metodi richiedono un controllo rigoroso delle condizioni di reazione per ottenere un’elevata purezza del prodotto finale.
Usi dell’acido acetico glaciale
L’acido acetico viene utilizzato in chimica analitica per la stima di sostanze debolmente alcaline come le ammidi organiche. L’acido acetico è una base molto più debole dell’acqua, quindi l’ammide si comporta come una base forte in questo mezzo. L’acido acetico diluito viene utilizzato per conservare e inscatolare sottaceti e altre verdure. Viene utilizzato anche come ablatore per la pulizia. Oltre alla pulizia e all’inscatolamento, l’acido acetico diluito può trattare o prevenire le infezioni batteriche o fungine dell’orecchio esterno.
