L’acetofenone o metilfenil chetone è un composto organico aromatico con la formula C8H8O. Viene utilizzato nella produzione di profumi e resine e come solvente e intermedio nei prodotti farmaceutici.
| Nome IUPAC | 1-feniletanone |
| Formula molecolare | C8H8O |
| numero CAS | 98-86-2 |
| Sinonimi | Metilfenilchetone, fenilmetilchetone, AP, acetilbenzene, benzoilmetile, etilfenilchetone, Hypnon |
| InChI | InChI=1S/C8H8O/c1-7(9)8-5-3-2-4-6-8/h2-6H,1H3 |
Struttura dell’acetofenone
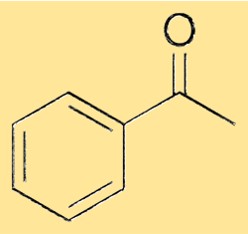
La struttura dell’acetofenone è costituita da un gruppo fenile legato a un gruppo carbonile tramite un singolo legame. Il gruppo carbonilico è costituito da un atomo di carbonio doppiamente legato ad un atomo di ossigeno. Il gruppo fenilico è un anello a sei membri di atomi di carbonio con cinque atomi di idrogeno attaccati e la sesta posizione è occupata dall’atomo di carbonio carbonilico. Questa struttura conferisce all’acetofenone le sue proprietà caratteristiche e gli consente di fungere da materia prima versatile per la sintesi di una varietà di sostanze chimiche.
Punto di fusione dell’acetofenone
L’acetofenone ha un punto di fusione di -15,7°C. Il punto di fusione è la temperatura alla quale un solido si trasforma in un liquido a pressione costante. L’acetofenone è un solido cristallino a temperatura ambiente e ha un punto di fusione relativamente basso rispetto ad altri composti simili. Il punto di fusione di un composto è determinato dalla sua struttura molecolare e dall’intensità delle sue forze intermolecolari.
Spettro IR dell’acetofenone
Lo spettro IR dell’acetofenone mostra picchi caratteristici a 1705 cm^-1, che corrisponde al gruppo carbonilico, e a 3030-3100 cm^-1, che corrisponde allo stiramento del CH aromatico. Questi picchi forniscono informazioni importanti riguardo ai gruppi funzionali presenti nella molecola.
Massa molare dell’acetofenone:
L’acetofenone ha una massa molare di 120,15 g/mol. È un composto organico aromatico con un gruppo carbonilico attaccato ad un anello fenilico. La massa molare è la somma delle masse atomiche degli atomi contenuti in una mole del composto. Nel caso dell’acetofenone, ha 8 atomi di carbonio, 8 atomi di idrogeno e un atomo di ossigeno, per un totale di 17 atomi in una molecola. La massa molare è una proprietà importante di un composto perché viene utilizzata per calcolare la quantità di sostanza contenuta in un dato campione, necessaria per varie applicazioni in chimica e nell’industria.
Punto di ebollizione dell’acetofenone
L’acetofenone ha un punto di ebollizione di 202°C. Il punto di ebollizione è la temperatura alla quale un liquido si trasforma in gas a pressione costante. L’acetofenone è un composto organico volatile e ha un punto di ebollizione relativamente alto rispetto ad altri composti simili. Il punto di ebollizione di un composto è determinato dall’intensità delle sue forze intermolecolari, che sono le forze che tengono insieme le molecole allo stato liquido o solido. Nel caso dell’acetofenone, ha un gruppo carbonilico polare che può formare legami idrogeno con altre molecole di acetofenone, il che rafforza le forze intermolecolari e aumenta il punto di ebollizione.
Densità del metilfenilchetone g/ml
Il metilfenilchetone ha una densità di 1,03 g/ml a temperatura ambiente. La densità è la massa di una sostanza per unità di volume. Il metilfenilchetone è un liquido a temperatura ambiente e ha una densità relativamente elevata rispetto ad altri composti simili. La densità di un composto è determinata dal suo peso molecolare e dalla densità delle sue molecole in un dato volume. Nel caso del metilfenilchetone, ha un peso molecolare relativamente elevato e una struttura molecolare relativamente compatta, che rende l’impacchettamento delle sue molecole più efficiente e ne aumenta la densità.
Peso molecolare del metilfenilchetone
Il metilfenilchetone ha un peso molecolare di 120,15 g/mol. Il peso molecolare è la somma dei pesi atomici di tutti gli atomi presenti in una molecola. Il metilfenil chetone ha 8 atomi di carbonio, 8 atomi di idrogeno e un atomo di ossigeno, per un totale di 17 atomi in una molecola. Il peso molecolare è una proprietà importante di un composto perché viene utilizzato per calcolare la quantità di sostanza contenuta in un dato campione, necessaria per varie applicazioni in chimica e nell’industria.
| Aspetto | Liquido da incolore a giallo pallido |
| Peso specifico | 1.028-1.031 a 25°C |
| Colore | Da incolore a giallo pallido |
| Odore | Dolce, floreale, mielato |
| Massa molare | 120,15 g/mole |
| Densità | 1,03 g/ml a 25°C |
| Punto di fusione | -15,7°C |
| Punto di ebollizione | 202°C |
| Punto flash | 78°C |
| solubilità in acqua | 3,3 g/l a 25°C |
| Solubilità | Solubile in alcool, etere, cloroformio e benzene |
| Pressione del vapore | 0,27 mmHg a 25°C |
| Densità del vapore | 4.15 (aria = 1) |
| pKa | 10.01 |
| pH | Non applicabile (il metilfenilchetone non è né un acido né una base) |
Sicurezza e pericoli del metilfenilchetone
Il metilfenilchetone può essere pericoloso se non maneggiato correttamente. Può causare irritazione alla pelle, agli occhi e al sistema respiratorio in caso di contatto o inalazione. L’esposizione diretta ad alte concentrazioni di vapori di metilfenilchetone può causare mal di testa, vertigini o nausea. L’ingestione di metilfenilchetone può causare irritazione gastrointestinale, vomito o diarrea. Anche il metilfenilchetone è infiammabile e può formare miscele esplosive con l’aria. Dovrebbe essere conservato in un luogo fresco, asciutto e ben ventilato, lontano da fonti di ignizione. Quando si maneggia il metilfenil chetone è necessario indossare dispositivi di protezione individuale, come guanti, occhiali di sicurezza e un respiratore.
| Simboli di pericolo | Xi: Irritante, F: Facilmente infiammabile |
| Descrizione della sicurezza | S16: Conservare lontano da fiamme e scintille – Non fumare, S26: In caso di contatto con gli occhi, lavare immediatamente e abbondantemente con acqua e consultare un medico, S36: Usare indumenti protettivi adatti, S37: Usare guanti adatti, S39: Usare indumenti protettivi adatti indumenti protettivi. protezione del viso |
| Numeri di identificazione delle Nazioni Unite | ONU 2319 |
| Codice SA | 291439 |
| Classe di pericolo | 3 (Liquidi infiammabili) |
| Gruppo di imballaggio | III |
| Tossicità | Il metilfenil chetone è classificato come irritante per gli occhi di categoria 3 e irritante per la pelle di categoria 4. Non è considerato cancerogeno o mutageno. La LD50 orale (dose letale per il 50% dei soggetti testati) nei ratti è di circa 3.000 mg/kg. Non è considerato un rischio ambientale significativo. |
Metodi per la sintesi del metilfenilchetone
Esistono vari metodi per sintetizzare il metilfenilchetone.
Un metodo comune è l’acilazione di Friedel-Crafts del benzene con acetil cloruro in presenza di un catalizzatore acido di Lewis come il cloruro di alluminio. Questa reazione produce metilfenilchetone e acido cloridrico come sottoprodotti.
Un altro metodo è l’ossidazione dell’etilbenzene utilizzando aria o ossigeno in presenza di un catalizzatore metallico come cobalto o manganese. Questa reazione produce metilfenilchetone e acido acetico come sottoprodotti.
Il metilfenilchetone può essere sintetizzato riducendo il fenilacetone utilizzando agenti riducenti come boroidruro di sodio o idruro di litio-alluminio. Questa reazione produce metilfenilchetone e il corrispondente alcol come sottoprodotti.
Un altro metodo prevede la reazione del cloruro di benzoile con l’etilbenzene in presenza di un catalizzatore di cloruro di alluminio per produrre metilfenil chetone e acido cloridrico come sottoprodotti.
Usi del metilfenilchetone
Il metilfenilchetone ha diversi usi in vari settori.
- Il metilfenilchetone è ampiamente utilizzato come solvente per varie resine, esteri di cellulosa e materie plastiche.
- L’industria alimentare utilizza il metilfenilchetone come agente aromatizzante, in particolare per i gusti di ciliegia e mandorla.
- L’industria dei profumi utilizza il metilfenilchetone come materia prima per la produzione di profumi e altri prodotti profumati.
- Vari prodotti chimici come prodotti farmaceutici, prodotti agrochimici e coloranti vengono sintetizzati utilizzando il metilfenil chetone.
- Il metilfenilchetone funge da intermedio nella produzione di fenilacetone, un precursore per la sintesi delle anfetamine.
- La cumarina, una fragranza utilizzata nei saponi e nei detergenti, è sintetizzata dal metilfenilchetone.
- I reagenti di chimica organica utilizzano il metilfenilchetone come reagente per la sintesi di vari composti.
- Il metilfenilchetone funge da materia prima per la produzione di altri prodotti chimici come stirene e metilstirene.
Nel complesso, il metilfenilchetone ha un’ampia gamma di applicazioni in vari settori grazie alle sue proprietà e usi versatili.
Domande:
D: L’acetofenone è polare?
R: Sì, l’acetofenone è polare a causa della presenza di un gruppo carbonilico (C=O) e di un anello fenilico, che crea un momento dipolare.
D: La benzaldeide o l’acetofenone sono più polari?
R: La benzaldeide è più polare dell’acetofenone perché ha un momento dipolare più elevato dovuto alla presenza di un gruppo aldeidico (CHO) oltre all’anello fenilico.
D: Spettro IR dell’acetofenone?
R: Lo spettro IR dell’acetofenone mostra una banda di assorbimento ampia e forte intorno a 1700 cm^-1, caratteristica della vibrazione di stiramento del carbonile (C=O). Mostra anche picchi intorno a 3000-3100 cm^-1, che corrisponde alle vibrazioni di stretching del CH aromatico.
D: Dall’acetofenone all’acido benzoico?
R: L’acetofenone può essere convertito in acido benzoico mediante ossidazione utilizzando un agente ossidante come il permanganato di potassio o l’acido cromico. Questa reazione provoca la scissione del legame carbonio-carbonio adiacente al gruppo carbonilico, seguita dall’ossidazione dell’intermedio risultante per produrre acido benzoico.
D: Dal benzene all’acetofenone?
R: Il benzene può essere convertito in acetofenone mediante acilazione di Friedel-Crafts utilizzando acetil cloruro o anidride acetica in presenza di un catalizzatore acido di Lewis come il cloruro di alluminio. Questa reazione comporta la sostituzione di un atomo di idrogeno del benzene con un gruppo acetile (-COCH3), seguito dal riarrangiamento per formare acetofenone.
