L’acetato di magnesio (Mg(C2H3O2)2) è un composto composto da ioni Mg2+ e C2H3O2-. È comunemente usato come agente essiccante nella sintesi organica e come additivo alimentare.
| Nome IUPAC | Acetato di magnesio |
| Formula molecolare | Mg(C2H3O2)2 |
| numero CAS | 142-72-3 |
| Sinonimi | Diacetato di magnesio, sale di magnesio dell’acido acetico, etanoato di magnesio, CAS 73567-85-6, EINECS 240-882-6, UNII-RS92S4G29A |
| InChI | InChI=1S/2C2H4O2.Mg/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
Proprietà dell’acetato di magnesio
Formula di acetato di magnesio
La formula chimica dell’acetato di magnesio è Mg(C2H3O2)2. Questa formula rappresenta la composizione del composto, con uno ione Mg2+ e due C2H3O2-. La formula è importante per determinare la quantità di composto necessaria per una particolare reazione. È utile anche per identificare il composto in diversi contesti.
Massa molare di acetato di magnesio
La massa molare di Mg(C2H3O2)2 è 142,39 g/mol. Questo valore si ottiene sommando le masse atomiche degli ioni Mg2+ (24,31 g/mol) e C2H3O2- (58,08 g/mol). La massa molare è una proprietà importante nel determinare la quantità di Mg(C2H3O2)2 necessaria per una particolare reazione.
Punto di ebollizione dell’acetato di magnesio
Mg(C2H3O2)2 ha un punto di ebollizione relativamente alto di 117,5°C (243,5°F). Questa proprietà è dovuta alla natura ionica del composto e alla forte attrazione elettrostatica tra gli ioni magnesio e acetato. A questa temperatura il composto inizierà a vaporizzare, ma rimarrà allo stato liquido se non sottoposto a temperature più elevate.
Acetato di magnesio Punto di fusione
Il punto di fusione di Mg(C2H3O2)2 è 160°C (320°F). Questo valore si ottiene riscaldando il composto fino a trasformarlo da solido a liquido. Il punto di fusione è una proprietà importante che determina la temperatura alla quale il composto passerà dallo stato solido a quello liquido. Questa proprietà è essenziale per la corretta manipolazione e conservazione del composto.
Densità dell’acetato di magnesio g/mL
La densità di Mg(C2H3O2)2 è 1,45 g/mL. Questo valore si ottiene dividendo la massa del composto per il suo volume. La densità è una proprietà importante che determina la massa di un particolare volume del composto. È anche una proprietà utile per determinare la purezza del composto, poiché le impurità possono influenzarne la densità.
Peso molecolare dell’acetato di magnesio
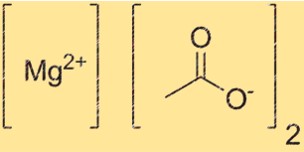
Il peso molecolare di Mg(C2H3O2)2 è 142,39 g/mol. Questo valore si ottiene sommando le masse atomiche del magnesio e due ioni acetato. Il peso molecolare è una proprietà importante che determina la quantità di un composto necessaria per una particolare reazione. È anche utile per determinare la purezza del composto.
Struttura dell’acetato di magnesio
Mg(C2H3O2)2 ha una struttura ionica in cui i cationi Mg2+ sono circondati da due anioni C2H3O2. Il catione Mg2+ ha una carica pari a +2, mentre l’anione C2H3O2- ha una carica pari a -1. La struttura è tenuta insieme dall’attrazione elettrostatica tra ioni di carica opposta.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 1,45 g/ml |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 142,39 g/mole |
| Densità | 1,45 g/ml |
| Punto di fusione | 160°C (320°F) |
| Punto di ebollizione | 117,5°C (243,5°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile |
| Solubilità | Solubile in etanolo, metanolo, acetone |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | 4.76 |
| pH | 7,5 – 9,0 |
Sicurezza e pericoli dell’acetato di magnesio
Il Mg(C2H3O2)2 è generalmente considerato sicuro per l’uso nelle applicazioni previste, ma come con qualsiasi composto chimico, esistono alcuni potenziali pericoli di cui essere consapevoli. Può irritare la pelle, gli occhi e il sistema respiratorio se inalato o ingerito. L’esposizione prolungata o ripetuta può causare effetti più gravi sulla salute. Il Mg(C2H3O2)2 deve essere maneggiato con cura e devono essere adottate misure protettive adeguate quando si maneggia questo composto. È inoltre importante seguire adeguati protocolli di conservazione e smaltimento per evitare esposizioni accidentali o danni ambientali.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | S22 – Non respirare le polveri; S24/25 – Evitare il contatto con la pelle e gli occhi; S36/37/39 – Indossare indumenti protettivi, guanti e proteggersi gli occhi/il viso adeguati; S45 – In caso di incidente o di malessere consultare immediatamente il medico (se possibile mostrare al medico l’etichetta) |
| Numeri di identificazione delle Nazioni Unite | Non applicabile |
| Codice SA | 29152900 |
| Classe di pericolo | Non classificato come pericoloso |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | Bassa tossicità, ma può irritare la pelle, gli occhi e il sistema respiratorio se non maneggiato correttamente |
Metodi di sintesi dell’acetato di magnesio
Sintetizzare Mg(C2H3O2)2 utilizzando vari metodi, inclusa la reazione dell’ossido di magnesio o dell’idrossido di magnesio con acido acetico .
In un metodo comune, aggiungere ossido di magnesio a una soluzione di acido acetico per formare Mg(C2H3O2)2 e acqua. Filtrare la soluzione risultante ed evaporarla per ottenere un prodotto solido Mg(C2H3O2)2.
Un altro metodo prevede la reazione del magnesio metallico con l’acido acetico in presenza di un catalizzatore, come il cloruro di rame o il solfato di rame. La reazione produce Mg(C2H3O2)2, gas idrogeno e rame metallico come sottoprodotto.
Sintetizzare Mg(C2H3O2)2 attraverso una reazione di metatesi facendo reagire il cloruro di magnesio con acetato di sodio in presenza di acqua per produrre Mg(C2H3O2)2 e cloruro di sodio.
Nel complesso, la scelta del metodo di sintesi dipende da fattori quali la purezza desiderata del prodotto Mg(C2H3O2)2, la disponibilità delle materie prime e la scala del processo di produzione.
Usi dell’acetato di magnesio
Mg(C2H3O2)2 ha un’ampia gamma di applicazioni in vari settori grazie alle sue proprietà uniche. Ecco alcuni usi comuni di Mg(C2H3O2)2:
- Additivi alimentari: utilizzati come additivi alimentari per migliorare il valore nutrizionale degli alimenti e prevenirne il deterioramento.
- Medicina: utilizzato in medicina come fonte di magnesio, un minerale essenziale che svolge un ruolo chiave in molti processi fisiologici.
- Tessili: utilizzato nell’industria tessile come mordente, una sostanza che aiuta a fissare i coloranti sui tessuti.
- Trattamento dell’acqua: utilizzato nelle applicazioni di trattamento dell’acqua per rimuovere le impurità dall’acqua e prevenire l’accumulo di calcare nei tubi e nelle apparecchiature.
- Calcestruzzo: utilizzato nella produzione di calcestruzzo per migliorarne la resistenza e la durabilità.
- Sintesi chimica: utilizzata come materia prima per la sintesi di altri composti chimici, come prodotti farmaceutici, aromi e profumi.
Domande:
D: Cosa si forma quando reagiscono l’acido acetico e il carbonato di magnesio?
R: Quando l’acido acetico e il carbonato di magnesio reagiscono, si formano Mg(C2H3O2)2, anidride carbonica e acqua.
D: Dove acquistare acetato di calcio e magnesio?
R: Il calcio Mg(C2H3O2)2 può essere acquistato da vari fornitori di prodotti chimici e mercati online.
D: L’acetato di magnesio è solubile in acqua?
R: Sì, Mg(C2H3O2)2 è solubile in acqua, con una solubilità di circa 54 g/L a temperatura ambiente.
D: Qual è la concentrazione molare di una soluzione da 5,00 L contenente 0,800 moli di acetato di magnesio?
R: La concentrazione molare di una soluzione da 5,00 L contenente 0,800 moli di Mg(C2H3O2)2 è 0,160 M.
