L’acetato di etile è un liquido incolore con odore fruttato. È comunemente usato come solvente in vari settori tra cui quello farmaceutico, cosmetico e alimentare. L’acetato di etile è altamente infiammabile e deve essere maneggiato con cura.
| Nome IUPAC | Acetato di etile |
| Formula molecolare | C4H8O2 |
| numero CAS | 141-78-6 |
| Sinonimi | Estere etilico dell’acido acetico, etanoato di etile, acetossietano, acetidina, acetato di etile, estere etilacetico |
| InChI | InChI=1S/C4H8O2/c1-3-6-4(2)5/h3H2.1-2H3 |
Proprietà dell’acetato di etile
Densità dell’acetato di etile g/ml
La densità dell’etanoato di etile è 0,902 g/ml in condizioni standard di temperatura e pressione. Questa densità indica che l’etanoato di etile è meno denso dell’acqua e galleggia sopra di essa. Questa proprietà lo rende utile per separare miscele liquide attraverso il processo di estrazione liquido-liquido.
Struttura dell’acetato di etile
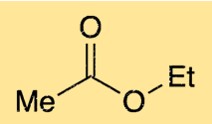
La struttura dell’etiletanoato è costituita da una catena a quattro atomi di carbonio con un gruppo funzionale estere. Il gruppo funzionale estere è costituito da un atomo di ossigeno legato ad un atomo di carbonio, che a sua volta è legato ad un altro atomo di ossigeno. L’atomo di ossigeno sul gruppo estere è anche legato a uno degli atomi di carbonio nella catena a quattro atomi di carbonio. Questa struttura conferisce all’etanoato di etile il suo caratteristico odore fruttato.
Massa molare dell’acetato di etile
La massa molare dell’acetato di etile è 88,11 g/mol. Viene determinato sommando i pesi atomici di tutti gli atomi in una molecola di acetato di etile. La formula molecolare dell’acetato di etile è C4H8O2, che indica che in ciascuna molecola sono presenti 4 atomi di carbonio, 8 atomi di idrogeno e 2 atomi di ossigeno. La massa molare dell’acetato di etile viene utilizzata in molti calcoli, come determinare la quantità di sostanza in un dato campione o la massa di una sostanza in un dato volume.
Punto di ebollizione dell’acetato di etile
Il punto di ebollizione dell’etanoato di etile è 77,1°C (171,8°F) a pressione standard. L’etanoato di etile ha un punto di ebollizione relativamente basso, che lo rende utile in molte applicazioni industriali come solvente per l’estrazione, la purificazione e la pulizia. Quando riscaldato al punto di ebollizione, l’etanoato di etile vaporizza e può essere raccolto come liquido puro attraverso la condensazione.
Punto di fusione dell’acetato di etile
Il punto di fusione dell’etanoato di etile è -83,6°C (-118,5°F). Questo basso punto di fusione significa che l’etanoato di etile si trova solitamente in forma liquida anziché solida a temperatura ambiente. Tuttavia, può solidificarsi a temperature estremamente basse o sotto pressione. La forma solida dell’etiletanoato è solitamente una polvere cristallina bianca.
Peso molecolare dell’acetato di etile
Il peso molecolare dell’etanoato di etile è 88,11 g/mol. Questo valore rappresenta la massa di una mole di molecole di etile etanoato. Il peso molecolare viene utilizzato in molti calcoli, come determinare la quantità di sostanza in un dato campione o la massa di una sostanza in un dato volume.
Formula di acetato di etile
La formula chimica dell’etanoato di etile è C4H8O2. Questa formula rappresenta il numero e il tipo di atomi che compongono una molecola di etanoato di etile. I quattro atomi di carbonio nella formula sono disposti in una catena, con ciascun atomo di carbonio legato ad altri due atomi. Due degli atomi di carbonio sono anche legati agli atomi di ossigeno nel gruppo funzionale estere. I restanti due atomi di carbonio sono legati ciascuno a tre atomi di idrogeno.
| Aspetto | Liquido incolore |
| Peso specifico | 0,902 g/cm³ |
| Colore | Incolore |
| Odore | Fruttato, dolce |
| Massa molare | 88,11 g/mole |
| Densità | 0,902 g/cm³ |
| Punto di fusione | -83,6°C |
| Punto di ebollizione | 77,1°C |
| Punto flash | -4°C |
| solubilità in acqua | 80 g/l a 20°C |
| Solubilità | Solubile in alcool, etere, acetone, cloroformio |
| Pressione del vapore | 73,3 mmHg a 20°C |
| Densità del vapore | 3.04 |
| pKa | 4.76 |
| pH | Neutro |
L’etanoato di etile è un liquido incolore ampiamente utilizzato in varie applicazioni industriali e di laboratorio. Tuttavia, comporta alcuni rischi per la sicurezza e la salute che devono essere considerati per garantire una manipolazione e un utilizzo sicuri. L’esposizione all’etanoato di etile può causare irritazione agli occhi, alla pelle e al sistema respiratorio. Può anche causare mal di testa, vertigini e nausea. L’etanoato di etile è infiammabile e può provocare incendi o esplosioni se esposto a calore o fiamme. È importante conservare e maneggiare l’etanoato di etile in un’area ben ventilata, lontano da fonti di ignizione. In caso di esposizione accidentale, è necessario consultare immediatamente un medico per prevenire ulteriori danni. Quando si maneggia l’etanoato di etile è necessario utilizzare precauzioni di sicurezza e dispositivi di protezione adeguati per ridurre al minimo il rischio di lesioni o danni.
| Simboli di pericolo | Xi, F |
| Descrizione della sicurezza | Evitare il contatto con la pelle e gli occhi. Tenere lontano da fonti di ignizione. Utilizzare in un’area ben ventilata. |
| Identificatori AN | UN1173 |
| Codice SA | 2915.31.00 |
| Classe di pericolo | 3 – Liquidi infiammabili |
| Gruppo di imballaggio | GE II |
| Tossicità | LD50 (orale, ratto) – 2 g/kg |
Metodi per la sintesi dell’acetato di etile
Due metodi principali, esterificazione e deidrogenazione, sintetizzano attivamente l’etanoato di etile nell’industria con rese elevate.
Il metodo di esterificazione prevede la reazione tra etanolo e acido acetico in presenza di un catalizzatore acido forte, come l’acido solforico. La distillazione separa l’etanoato di etile e l’acqua, risultanti dalla reazione, per produrre rese elevate di etanoato di etile, comunemente utilizzato nell’industria.
Il metodo della deidrogenazione prevede la reazione di etanolo e acido acetico su un catalizzatore di ossido di rame (II) ad alta temperatura. Il catalizzatore promuove la deidrogenazione dell’etanolo per produrre etilene, che poi reagisce con l’acido acetico per formare etanoato di etile. Questo metodo è meno comune dell’esterificazione e generalmente richiede temperature più elevate e tempi di reazione più lunghi.
Un altro metodo per sintetizzare l’etanoato di etile prevede la reazione di etanolo e anidride acetica. Questo metodo porta alla produzione di etanoato di etile e acido acetico, che possono essere separati mediante distillazione.
Usi dell’acetato di etile
L’etanoato di etile è un composto chimico versatile ampiamente utilizzato in varie applicazioni industriali e di consumo. Alcuni degli usi più comuni dell’etil etanoato sono:
- Solvente: i produttori lo utilizzano come potente solvente in vernici, rivestimenti e adesivi.
- Agente aromatizzante: utilizzato come agente aromatizzante nell’industria alimentare e delle bevande, in particolare nella produzione di bevande aromatizzate alla frutta.
- Fragranza: un ingrediente comune nei profumi, nelle colonie e in altri prodotti per la cura personale grazie al suo gradevole odore fruttato.
- Estrazione dell’olio essenziale: utilizzato nell’estrazione degli oli essenziali da piante e fiori.
- Prodotti farmaceutici: utilizzato come solvente nella produzione di prodotti farmaceutici, in particolare nella produzione di antibiotici.
- Detergente: utilizzato per pulire dispositivi elettronici, tessuti e altri materiali.
- Pelle artificiale: i produttori di pelle artificiale ammorbidiscono e rendono il materiale più elastico utilizzando l’acetato di etile come plastificante.
- Intermedio chimico: i produttori chimici creano altri prodotti chimici, come acetato di cellulosa, acetato di vinile ed etil acrilato, utilizzando l’etanoato di etile come intermedio chimico.
Domande:
D: L’acetato di etile è polare o non polare?
R: L’etanoato di etile è un solvente polare a causa della presenza del gruppo carbonilico (C=O) e dell’atomo di ossigeno nella sua struttura molecolare. Tuttavia, non è polare come altri solventi come l’acqua o l’etanolo.
D: L’acetato di etile è miscibile con l’acqua?
R: L’etanoato di etile è immiscibile con l’acqua, il che significa che non si mescola bene con l’acqua. Ciò è dovuto alla differenza di polarità tra le due sostanze, poiché l’acqua è un solvente altamente polare e l’etanoato di etile è un solvente meno polare.
D: L’acetato di etile è solubile in acqua?
R: L’etanoato di etile è leggermente solubile in acqua, con una solubilità di circa l’8% a temperatura ambiente. Tuttavia questa solubilità è limitata a causa della differenza di polarità tra le due sostanze. L’etanoato di etile è più solubile in solventi non polari come l’esano o il toluene.
