L’acetato di ammonio è un composto utilizzato in vari settori. Agisce come fonte di ioni acetato e svolge un ruolo nelle reazioni chimiche e nella sintesi organica.
| Nome IUPAC | Acetato di ammonio |
| Formula molecolare | C2H7NO2 |
| numero CAS | 631-61-8 |
| Sinonimi | Sale di ammonio dell’acido acetico, etanoato di ammonio, acido acetico di ammonio, acido acetico, sale di ammonio |
| InChI | InChI=1S/C2H4O2.H3N/c1-2(3)4;/h1H3,(H,3,4);1H3 |
Proprietà dell’acetato di ammonio
Formula di acetato di ammonio
La formula del sale di ammonio dell’acido acetico è C2H7NO2. È costituito da due atomi di carbonio, sette atomi di idrogeno, un atomo di azoto e due atomi di ossigeno.
Massa molare dell’acetato di ammonio
La massa molare del sale di ammonio dell’acido acetico si calcola sommando le masse atomiche dei suoi elementi costitutivi. Questo corrisponde a circa 77,0825 grammi per mole.
Punto di ebollizione dell’acetato di ammonio
Il sale di ammonio dell’acido acetico ha un punto di ebollizione di circa 117 gradi Celsius. A questa temperatura il composto subisce un cambiamento di fase da liquido a gassoso.
Acetato di ammonio Punto di fusione
Il punto di fusione del sale di ammonio dell’acido acetico è di circa 114 gradi Celsius. Questa è la temperatura alla quale il composto solido passa allo stato liquido.
Densità dell’acetato di ammonio g/mL
La densità del sale di ammonio dell’acido acetico è di circa 1,17 grammi per millilitro. È una misura della massa per unità di volume del composto.
Peso molecolare dell’acetato di ammonio
Il peso molecolare del sale di ammonio dell’acido acetico è di circa 77,0825 grammi per mole. È la somma dei pesi atomici di tutti gli atomi presenti nel composto.
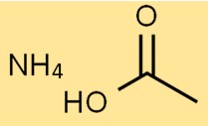
Struttura dell’acetato di ammonio
La struttura del sale di ammonio dell’acido acetico è costituita da uno ione NH4+ e uno ione CH3COO-. Lo ione NH4+ è carico positivamente, mentre lo ione CH3COO- è carico negativamente.
Solubilità dell’acetato di ammonio
Il sale di ammonio dell’acido acetico è altamente solubile in acqua. Si dissolve facilmente in acqua per formare una soluzione limpida e incolore. La solubilità del sale di ammonio dell’acido acetico in acqua è dovuta alla sua capacità di formare legami idrogeno con le molecole d’acqua.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 1,17 g/ml |
| Colore | Incolore |
| Odore | Inodore |
| Massa molare | 77,0825 g/mole |
| Densità | 1,17 g/ml |
| Punto di fusione | 114°C |
| Punto di ebollizione | 117°C |
| Punto flash | Non applicabile |
| solubilità in acqua | molto solubile in acqua |
| Solubilità | Solubile in acqua, acido acetico, etanolo |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | 4,75 |
| pH | Circa 6.0-7.0 |
Sicurezza e pericoli dell’acetato di ammonio
Il sale di ammonio dell’acido acetico presenta rischi minimi per la sicurezza se maneggiato correttamente. Il suo utilizzo è generalmente considerato sicuro in varie applicazioni. Tuttavia, come con qualsiasi sostanza chimica, è necessario prendere precauzioni. Evitare l’inalazione di polveri o vapori poiché potrebbero causare irritazioni alle vie respiratorie. Si consiglia di indossare adeguati dispositivi di protezione individuale, inclusi guanti e occhiali di sicurezza, quando si lavora con il sale di ammonio dell’acido acetico. In caso di ingestione accidentale o di contatto con gli occhi o la pelle, sciacquare abbondantemente con acqua ed eventualmente consultare un medico. Conservare il sale di ammonio dell’acido acetico in un luogo fresco e asciutto, lontano da sostanze incompatibili. Seguire le corrette procedure di manipolazione e smaltimento per garantire la sicurezza.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | Bassa tossicità |
| Numeri di identificazione delle Nazioni Unite | Non regolato |
| Codice SA | 2915.29.10 |
| Classe di pericolo | Il sale di ammonio dell’acido acetico non è classificato |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | Bassa tossicità |
Metodi per la sintesi dell’acetato di ammonio
Esistono diversi metodi per sintetizzare il sale di ammonio dell’acido acetico. Un approccio comune consiste nel mescolare l’acido acetico con una soluzione acquosa di carbonato di ammonio . La reazione tra loro produce sale di ammonio e acqua acetica. Questo metodo richiede il controllo della temperatura e della pressione durante la reazione.
In un altro metodo, i chimici aggiungono gradualmente acido acetico a una soluzione di ammoniaca mescolando fino a raggiungere il pH desiderato. Questo processo di neutralizzazione converte l’acido acetico nel sale di ammonio dell’acido acetico. Durante questa reazione sono essenziali un’attenta miscelazione e il controllo del pH.
Utilizzare l’idrossido di ammonio per sintetizzare il sale di ammonio dell’acido acetico combinandolo con l’acido acetico , con conseguente formazione di sale di ammonio dell’acido acetico e acqua. Monitorare l’avanzamento di questa reazione fino al suo completamento.
Mescolare l’anidride acetica con idrossido di ammonio o ammoniaca per preparare il sale di ammonio dell’acido acetico. La reazione tra questi reagenti porta alla formazione di un sale di ammonio dell’acido acetico.
Ricordare che è essenziale effettuare la sintesi del sale d’ammonio dell’acido acetico in un’area ben ventilata e seguire le opportune misure di sicurezza. Durante tutto il processo di sintesi, garantire la corretta manipolazione e conservazione delle sostanze chimiche.
Usi dell’acetato di ammonio
Il sale di ammonio dell’acido acetico trova varie applicazioni in diversi settori grazie alle sue proprietà versatili. Ecco alcuni usi comuni:
- Il sale di ammonio dell’acido acetico tampona le soluzioni e mantiene un livello di pH stabile nei laboratori chimici e biologici.
- I metodi analitici come la cromatografia e la spettrometria di massa utilizzano il sale di ammonio dell’acido acetico come reagente per la ionizzazione e la separazione dei composti.
- La biologia molecolare utilizza il sale di ammonio dell’acido acetico per far precipitare il DNA durante le procedure di purificazione, rimuovendo così contaminanti e impurità.
- Il sale di ammonio dell’acido acetico partecipa a molte reazioni chimiche, agendo come fonte di ioni acetato nella sintesi organica, reazioni di esterificazione e processi catalitici.
- In agricoltura, il sale di ammonio dell’acido acetico funge da fonte di azoto nei fertilizzanti, favorendo la crescita e lo sviluppo delle piante.
- Le industrie tessili utilizzano il sale di ammonio dell’acido acetico per tingere e stampare i tessuti, migliorando così la solidità del colore fissando i coloranti al tessuto.
- L’industria alimentare approva il sale di ammonio dell’acido acetico come additivo alimentare, regolando l’acidità per controllare il pH di vari prodotti alimentari.
- Nelle tecniche di analisi chimica come HPLC (cromatografia liquida ad alte prestazioni), il sale di ammonio dell’acido acetico facilita la separazione e il rilevamento dei composti.
Nel complesso, il sale di ammonio dell’acido acetico è un composto versatile con usi che vanno dalle applicazioni di laboratorio all’agricoltura e all’industria alimentare. Le sue proprietà uniche lo rendono un ingrediente importante in vari processi e prodotti.
Domande:
D: Quanti atomi di idrogeno ci sono in una molecola di acetato di ammonio, NH4C2H3O2?
R: Ci sono quattro atomi di idrogeno in una molecola di sale di ammonio dell’acido acetico (NH4C2H3O2).
D: L’acetato di ammonio è solubile?
R: Sì, il sale di ammonio dell’acido acetico è solubile in acqua.
D: Qual è la formula dell’acetato di ammonio?
R: La formula del sale di ammonio dell’acido acetico è NH4C2H3O2.
D: L’acetato di ammonio è solubile in acqua?
R: Sì, il sale di ammonio dell’acido acetico è solubile in acqua.
D: Come preparare l’acetato di ammonio 1M?
R: Per preparare il sale di ammonio 1M dell’acido acetico, sciogliere la quantità appropriata di acetato di ammonio in acqua per ottenere una concentrazione di 1 mole per litro (M).
D: Quante moli totali di ioni vengono rilasciate quando 0,624 moli di acetato di ammonio vengono sciolte in acqua?
R: Quando 0,624 moli di sale di ammonio dell’acido acetico vengono sciolte in acqua, vengono rilasciate un totale di 1,248 moli di ioni (NH4+ e C2H3O2-).
D: Qual è l’esatto peso molecolare dell’acetato di ammonio (NH4OAc)?
R: L’esatto peso molecolare del sale di ammonio dell’acido acetico (NH4OAc) è di circa 77,0825 grammi per mole.
D: Come produrre acetato di ammonio 5M?
R: Per preparare il sale di ammonio 5M dell’acido acetico, sciogliere la quantità appropriata di acetato di ammonio in acqua per raggiungere una concentrazione di 5 moli per litro (M).
D: Qual è il pKa dell’acido acetico e il pKb dell’idrossido di ammonio?
R: Il pKa dell’acido acetico è circa 4,75 e il pKb del sale di ammonio dell’acido acetico è circa 4,25.
