L’acetammide è un solido cristallino bianco con un leggero odore. Viene sintetizzato facendo reagire l’acido acetico con l’ammoniaca. È comunemente usato nella produzione di materie plastiche e prodotti farmaceutici.
| Nome IUPAC | Etanammide |
| Formula molecolare | C2H5NO |
| numero CAS | 60-35-5 |
| Sinonimi | Ammide dell’acido acetico, etamide, etanammide, CH3CONH2 |
| InChI | InChI=1S/C2H5NO/c1-2(3)4/h1H3,(H2,3,4) |
Proprietà dell’acetamide
Massa molare dell’acetamide
L’acetammide ha una massa molare di 59,07 g/mol, che è la somma delle masse atomiche di tutti gli atomi in una molecola di acetamide. La massa molare di un composto è utile per determinare il numero di moli del composto presente in un dato campione. Viene anche utilizzato per calcolare la composizione percentuale in massa del composto.
Punto di ebollizione dell’acetamide
Il punto di ebollizione dell’etanammide è 222°C. Questa è la temperatura alla quale l’etanamide passa da liquido a gas. Il punto di ebollizione di una sostanza è influenzato dalla forza delle sue forze intermolecolari e l’etanamide ha forti legami idrogeno tra le sue molecole. Pertanto, ha un punto di ebollizione relativamente alto rispetto ad altre ammidi.
Punto di fusione dell’acetammide
Il punto di fusione dell’etanammide è 82,5°C. Questa è la temperatura alla quale l’etanamide passa da solido a liquido. Il punto di fusione di una sostanza è influenzato dall’intensità delle sue forze intermolecolari e, nel caso dell’etanammide, tra le sue molecole sono presenti forti legami idrogeno. Pertanto, il suo punto di fusione è relativamente alto rispetto ad altre ammidi.
Densità dell’acetamide g/ml
La densità dell’etanammide è 1,16 g/mL. La densità è la massa di una sostanza per unità di volume ed è una proprietà fisica utile per identificare e caratterizzare le sostanze. L’acetammide è un composto relativamente denso e la sua densità può essere utilizzata nei calcoli per varie applicazioni.
Peso molecolare dell’acetamide
Il peso molecolare dell’acetamide è 59,07 g/mol. Questo valore è utile per determinare la quantità di acetamide presente in un campione, nonché per calcoli stechiometrici nelle reazioni chimiche.
Struttura dell’acetamide
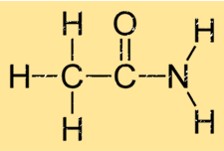
L’acetamide ha una struttura semplice costituita da un gruppo carbonilico (C=O) attaccato a un gruppo amminico (NH2). Questo gli dà la formula molecolare C2H5NO. I gruppi carbonilico e amminico sono uniti da un singolo atomo di carbonio. La struttura dell’etanammide le consente di formare forti legami idrogeno con altre molecole di etanammide, il che contribuisce alle sue proprietà fisiche come il punto di ebollizione e il punto di fusione.
Formula dell’acetamide
La formula chimica dell’etanammide è CH3CONH2, che indica che contiene un atomo di carbonio, due atomi di idrogeno, un atomo di azoto e un atomo di ossigeno. La formula è utile per identificare gli elementi e i loro rapporti presenti nel composto. È utile anche per determinare la stechiometria delle reazioni chimiche che coinvolgono l’etanamide.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 1,16 g/ml |
| Colore | Incolore |
| Odore | Leggero odore |
| Massa molare | 59,07 g/mole |
| Densità | 1,16 g/ml |
| Punto di fusione | 82,5°C |
| Punto di ebollizione | 222°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Completamente miscibile |
| Solubilità | Solubile in etanolo, etere, benzene e cloroformio |
| Pressione del vapore | 0,000138 mmHg a 25°C |
| Densità del vapore | 2.1 |
| pKa | 16.5 |
| pH | 6,5 – 7,5 (soluzione acquosa al 10%) |
Sicurezza e pericoli dell’acetamide
L’acetamide è considerato un composto relativamente sicuro, ma può comunque presentare alcuni pericoli. Può causare irritazione alla pelle, agli occhi e al sistema respiratorio in caso di esposizione prolungata. Se ingerito può anche causare irritazione gastrointestinale e depressione del sistema nervoso centrale. L’acetamide è combustibile e può provocare incendi se esposta a calore o fiamme. È importante maneggiare l’etanamide con cura e utilizzare dispositivi di protezione, come guanti e occhiali di sicurezza, quando si lavora con esso. Sono inoltre necessari una ventilazione e uno stoccaggio adeguati per evitare esposizioni non necessarie e ridurre al minimo i rischi potenziali.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | Evitare l’esposizione prolungata. Indossare dispositivi di protezione. Sono necessarie ventilazione e stoccaggio adeguati. |
| Numeri di identificazione delle Nazioni Unite | Non applicabile |
| Codice SA | 29242990 |
| Classe di pericolo | Non classificato come pericoloso da OSHA o GHS |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | LD50 (orale, ratto): 3,8 g/kg; LC50 (inalazione, ratto): >20 mg/L (esposizione di 4 ore) |
Metodi di sintesi dell’acetamide
L’ammoniaca o i sali di ammonio possono reagire con l’acido acetico per sintetizzare l’etanammide, l’ammoniaca può reagire con il cloruro di acetile per sintetizzare l’etanammide e l’acetato di ammonio può subire disidratazione per sintetizzare l’etanammide.
Nel primo metodo, l’ossido di zinco o il rame catalizzano la reazione dell’acido acetico e dell’ammoniaca o dei sali di ammonio per sintetizzare l’etanammide. La reazione produce etanamide e acqua come sottoprodotti.
Nel secondo metodo, una base come l’idrossido di sodio o il gas di ammoniaca reagisce con il cloruro di acetile per produrre etanammide. La reazione produce etanammide e gas di acido cloridrico come sottoprodotti.
Nel terzo metodo, un agente disidratante come l’acido solforico facilita la disidratazione dell’acetato di ammonio per sintetizzare etanammide e acqua come sottoprodotto.
Usi dell’acetamide
L’acetamide ha molti usi in diversi settori grazie alle sue proprietà uniche. Alcuni degli usi comuni dell’etanamide sono:
- Solvente: i produttori lo utilizzano spesso come solvente per produrre plastica, fibre e resine.
- Industria farmaceutica: utilizzato nell’industria farmaceutica come materia prima per la sintesi di vari farmaci e anche come stabilizzante per alcuni antibiotici.
- Industria tessile: utilizzato nell’industria tessile come ammorbidente per fibre sintetiche come il nylon e come agente colorante per cotone e altre fibre naturali.
- Industria chimica: utilizzato anche come intermedio chimico nella produzione di vari prodotti chimici come acrilonitrile, anidride acetica e acrilammide.
- Industria alimentare: utilizzato come agente aromatizzante e ingrediente in alcuni prodotti alimentari come prodotti da forno, caramelle e gelati.
- Ricerca di laboratorio: utilizzato nella ricerca di laboratorio come solvente, reagente e anche come denaturante per le proteine.
Domande:
D: Quale reagente o sequenza di reagenti convertirà l’acetamide in acetato di etile?
R: L’acetammide può essere convertita in acetato di etile facendola reagire con cloroformiato di etile in presenza di una base come la piridina. La reazione produce acetato di etile, anidride carbonica e gas di acido cloridrico come sottoprodotti.
D: L’acetamide è un amminoacido?
R: No, l’etanamide non è un amminoacido. È un derivato dell’acido acetico e contiene un gruppo funzionale ammidico (-CONH2) invece di un gruppo amminico (-NH2).
D: Qual è il prodotto della reazione dell’acetamide con HO-?
R: La reazione dell’acetamide con HO- (ione idrossido) provoca l’idrolisi dell’acetamide per formare acido acetico e ammoniaca.
D: Come posso rimuovere il solvente acetammide dai cristalli?
R: Per rimuovere il solvente etanammidico dai cristalli, è possibile utilizzare tecniche come la ricristallizzazione o la filtrazione sotto vuoto. La ricristallizzazione prevede la dissoluzione dei cristalli in un solvente adatto, come l’acqua, quindi lasciando evaporare lentamente il solvente per ottenere cristalli puri. La filtrazione sotto vuoto prevede il filtraggio dei cristalli attraverso carta da filtro a pressione ridotta per rimuovere qualsiasi solvente residuo di etanammide.
D: L’acetamide ha un legame idrogeno?
R: Sì, l’etanammide può partecipare ai legami idrogeno grazie alla presenza di un accettore di legami idrogeno (-CO) e di un donatore di legami idrogeno (-NH2) nella sua struttura molecolare.
