Il triossido di cromo, noto anche come acido cromico, è un composto inorganico con la formula CrO3. È l’anidride acida dell’acido cromico ed è talvolta commercializzata con lo stesso nome.
| Nome IUPAC | Ossido di cromo (VI). |
| Formula molecolare | CrO3 |
| numero CAS | 1333-82-0 |
| Sinonimi | Anidride cromica, anidride di ossido di cromo, trioxocromo Ossido di cromo (VI) |
| InChI | InChI=1S/Cr.3O |
Proprietà del triossido di cromo
Formula del triossido di cromo
La formula dell’anidride cromica è CrO3. È costituito da un atomo di cromo legato a tre atomi di ossigeno.
Massa molare del triossido di cromo
La massa molare dell’anidride cromica si calcola sommando le masse atomiche dei suoi elementi costitutivi, che sono il cromo (Cr) e l’ossigeno (O). La massa molare è di circa 99,994 g/mol.
Punto di ebollizione del triossido di cromo
L’anidride cromica non ha un punto di ebollizione distinto. Quando riscaldato, si decompone in ossido di cromo e ossigeno gassoso senza passare attraverso una fase liquida.
Punto di fusione del triossido di cromo
Il punto di fusione dell’anidride cromica è di circa 196°C. A questa temperatura passa dallo stato solido a quello liquido.
Densità del triossido di cromo g/mL
La densità dell’anidride cromica è di circa 2,7 g/mL. Questo valore rappresenta la massa del composto per unità di volume.
Peso molecolare del triossido di cromo
Il peso molecolare dell’anidride cromica, detta anche massa molare, è di circa 99,994 g/mol. È la somma delle masse atomiche degli atomi di cromo e ossigeno nel composto.
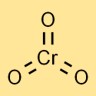
Struttura del triossido di cromo
L’anidride cromica ha una struttura molecolare in cui un atomo di cromo è legato centralmente a tre atomi di ossigeno. Adotta una geometria tetraedrica, con l’atomo di cromo al centro e gli atomi di ossigeno agli angoli.
Solubilità del triossido di cromo
L’anidride cromica è altamente solubile in acqua. Si dissolve facilmente, formando una soluzione di acido cromico. La solubilità dell’anidride cromica in acqua ne consente l’utilizzo in vari processi e applicazioni chimici.
| Aspetto | Cristalli rosso scuro |
| Peso specifico | 2,7 g/ml |
| Colore | Rosso scuro |
| Odore | Inodore |
| Massa molare | 99,994 g/mole |
| Densità | 2,7 g/ml |
| Punto di fusione | 196°C |
| Punto di ebollizione | Decomposto |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile |
| Solubilità | Solubile in vari solventi come etanolo, etere, ecc. |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Acido (in soluzione) |
Sicurezza e pericoli del triossido di cromo
L’anidride cromica comporta notevoli rischi per la sicurezza e deve essere maneggiata con cura. È una sostanza altamente corrosiva e ossidante, capace di provocare gravi ustioni alla pelle, agli occhi e al sistema respiratorio. L’inalazione o l’ingestione di anidride cromica può causare difficoltà respiratorie, problemi gastrointestinali e persino danni agli organi.
Quando si lavora con l’anidride cromica è necessario indossare dispositivi di protezione individuale (DPI) adeguati, inclusi guanti, occhiali e un respiratore. Dovrebbe essere conservato in un luogo fresco e asciutto, lontano da materiali incompatibili e fonti di ignizione.
Lo smaltimento dell’anidride cromica deve essere effettuato in conformità con le normative locali, poiché è considerato un rifiuto pericoloso. Non deve essere rilasciato nell’ambiente.
| Simboli di pericolo | Corrosivo, Ossidante |
| Descrizione della sicurezza | Evitare il contatto con la pelle, gli occhi e l’inalazione. Utilizzare dispositivi di protezione adeguati. |
| Numeri di identificazione delle Nazioni Unite | ONU 1463 |
| Codice SA | 2819.90.90 |
| Classe di pericolo | 5.1 (Agente ossidante) |
| Gruppo di imballaggio | II |
| Tossicità | Molto tossico |
Metodi di sintesi del triossido di cromo
Esistono diversi metodi per sintetizzare l’anidride cromica.
Un metodo comune prevede la reazione tra bicromato di sodio e acido solforico . In un ambiente controllato, qualcuno mescola il dicromato di sodio (Na2Cr2O7) con acido solforico concentrato (H2SO4) . La reazione porta alla formazione di una soluzione rosso scuro di anidride cromica (CrO3) e solfato di sodio (Na2SO4) come sottoprodotto.
Un altro metodo prevede l’ossidazione dei composti di cromo (III) utilizzando forti agenti ossidanti come il perossido di idrogeno (H2O2) o l’acido nitrico (HNO3) . In questo processo, mescolare il composto di cromo (III) con l’agente ossidante in condizioni specifiche per convertire il cromo (III) in anidride cromica.
Preparare l’anidride cromica facendo reagire il cromo metallico o i composti di cromo (II) con forti agenti ossidanti come il permanganato di potassio (KMnO4) o il dicromato di potassio (K2Cr2O7). La reazione porta alla formazione di anidride cromica.
È importante notare che la sintesi dell’anidride cromica deve essere effettuata con adeguate misure di sicurezza e nel rispetto delle normative appropriate. Gli individui esperti dovrebbero condurre il processo di sintesi in laboratori ben attrezzati per garantire la loro sicurezza e ridurre al minimo l’impatto ambientale.
Usi del triossido di cromo
L’anidride cromica trova applicazione come agente ossidante in vari processi chimici, inclusa la produzione di composti organici.
- I produttori lo utilizzano per produrre coloranti e pigmenti, come il giallo cromo e il verde cromo.
- L’industria galvanica lo utilizza per depositare il cromo sulle superfici metalliche, fornendo resistenza alla corrosione e una finitura attraente.
- Viene utilizzato nella preparazione di catalizzatori di cromo per reazioni di polimerizzazione nella produzione di materie plastiche e materiali sintetici.
- Svolge un ruolo nella sintesi di prodotti farmaceutici e intermedi organici.
- I trattamenti preservanti del legno lo utilizzano come fungicida e insetticida per proteggere dalla putrefazione e dai parassiti.
- I laboratori lo utilizzano come reagente per vari test e analisi chimiche.
- Il suo utilizzo nella produzione di vetri e ceramiche specializzate esalta i colori e le proprietà specifiche.
- L’industria conciaria lo utilizza per trattare il cuoio, aiutando a stabilizzare e tingere le pelli.
- È un componente nella formulazione di detergenti e trattamenti superficiali per superfici metalliche.
È importante maneggiare l’anidride cromica con cautela a causa della sua natura tossica e corrosiva. Il rispetto di adeguati protocolli di sicurezza garantisce la tutela delle persone e dell’ambiente durante l’utilizzo e lo smaltimento.
Domande:
D: Cos’è CrO3?
R: CrO3 è l’anidride cromica, un composto costituito da un atomo di cromo legato a tre atomi di ossigeno.
D: CrO3 è un forte agente ossidante?
R: Sì, CrO3 è un potente agente ossidante comunemente utilizzato nelle reazioni chimiche per facilitare l’ossidazione di vari composti.
D: Cosa fa CrO3 all’alcol?
R: CrO3 può ossidare gli alcoli e convertirli nei corrispondenti composti carbonilici, come aldeidi o chetoni.
D: Quale prodotto organico otterresti dalla reazione dell’1-pentanolo con CrO3, H2O e H2SO4?
R: La reazione produrrebbe il prodotto organico 1-pentanone, che è un chetone.
D: Qual è la scelta migliore del reagente per eseguire la seguente trasformazione: PCC, HIO4, CrO3, NaOH?
R: La scelta migliore del reagente per questa trasformazione sarebbe il PCC (clorocromato di piridinio).
D: CrO3 è anfotero?
R: No, CrO3 non è anfotero. È un composto molto acido ma incapace di mostrare proprietà basiche.
D: Come trovare il numero di ossidazione del Cr in CrO3?
R: Il numero di ossidazione del Cr in CrO3 è +6.
D: Qual è il nome di CrO3?
R: Il nome di CrO3 è anidride cromica.
D: Cosa fa CrO3 agli alcoli non anonici?
R: CrO3 può ossidare gli alcoli non anonici, convertendoli nei corrispondenti composti carbonilici, come i chetoni non anonici.
D: Qual è la carica del catione del metallo di transizione in CrO3?
R: Il catione del metallo di transizione in CrO3, che è il cromo, ha una carica di +6.
