Il dicromato di potassio è un composto chimico arancione brillante utilizzato in una varietà di applicazioni. È un forte agente ossidante e può essere tossico se ingerito o inalato.
| Nome IUPAC | Potassio bicromato |
| Formula molecolare | K2Cr2O7 |
| numero CAS | 7778-50-9 |
| Sinonimi | Dicromato di potassio, Cromato di potassio (VI), Dicromato di potassio |
| InChI | InChI=1S/2Cr.2K.7O/q;;2*+1;;;;;;/h;;2*;7*1- |
Proprietà del bicromato di potassio
Formula del dicromato di potassio
La formula del dicromato di potassio è K2Cr2O7. È costituito da due atomi di potassio (K), due atomi di cromo (Cr) e sette atomi di ossigeno (O). Ogni atomo di potassio ha una carica +1, mentre ogni atomo di cromo ha una carica +6. La presenza di due atomi di cromo nella formula indica la struttura dimerica del composto.
Massa molare del dicromato di potassio
La massa molare del dicromato di potassio si calcola sommando le masse atomiche dei suoi elementi costitutivi. Il potassio ha una massa molare di 39,10 grammi per mole (g/mol), il cromo ha una massa molare di 52,00 g/mol e l’ossigeno ha una massa molare di 16,00 g/mol. La massa molare del dicromato di potassio è quindi 294,18 g/mol.
Punto di ebollizione del bicromato di potassio
Il bicromato di potassio non ha un punto di ebollizione specifico, poiché si decompone prima di raggiungere un punto di ebollizione. Tuttavia, quando riscaldato, subisce una decomposizione termica, rilasciando fumi tossici di ossido di cromo e ossigeno.
Dicromato di potassio Punto di fusione
Il punto di fusione del dicromato di potassio è di circa 398 gradi Celsius (°C) o 748 gradi Fahrenheit (°F). A questa temperatura, i cristalli solidi di bicromato di potassio si trasformano in uno stato liquido.
Densità del dicromato di potassio g/mL
La densità del dicromato di potassio è di circa 2,68 grammi per millilitro (g/mL). Ciò indica che un dato volume di bicromato di potassio è relativamente più pesante di un uguale volume di acqua.
Peso molecolare del bicromato di potassio
Il peso molecolare del dicromato di potassio è uguale alla sua massa molare, ovvero 294,18 grammi per mole (g/mol). Rappresenta la massa combinata di tutti gli atomi presenti in una molecola del composto.
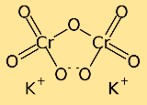
Struttura del bicromato di potassio
Il bicromato di potassio ha una struttura dimerica, nel senso che è costituito da due atomi di cromo legati insieme da atomi di ossigeno. Gli atomi di potassio sono anche legati agli atomi di ossigeno, creando una complessa rete di atomi nel composto.
Solubilità del bicromato di potassio
Il bicromato di potassio è molto solubile in acqua. Si dissolve facilmente in acqua per formare una soluzione arancione. La solubilità del dicromato di potassio aumenta con la temperatura. Tuttavia la sua solubilità nei solventi organici è limitata.
| Aspetto | Cristalli arancioni luminosi |
| Peso specifico | 2,68 g/ml |
| Colore | Arancia |
| Odore | Inodore |
| Massa molare | 294,18 g/mole |
| Densità | 2,68 g/ml |
| Punto di fusione | 398°C (748°F) |
| Punto di ebollizione | Decomposto |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile |
| Solubilità | Solubile in acqua, limitato nei solventi organici |
| Pressione del vapore | Trascurabile |
| Densità del vapore | Non disponibile |
| pKa | Non applicabile |
| pH | Acido (intorno a pH 4) |
Sicurezza e pericoli del dicromato di potassio
Il dicromato di potassio presenta notevoli rischi per la sicurezza. È altamente tossico se ingerito, inalato o entra in contatto con la pelle. Il composto è un forte agente ossidante che può reagire violentemente con materiali combustibili, aumentando il rischio di incendio. L’esposizione al dicromato di potassio può causare gravi irritazioni cutanee, ustioni e reazioni allergiche. L’inalazione dei suoi fumi o polveri può causare problemi respiratori e danni ai polmoni. L’esposizione a lungo termine è associata ad effetti avversi sulla salute, compreso il cancro ai polmoni indotto dai cromati. È essenziale maneggiare il dicromato di potassio con estrema cautela, indossando dispositivi di protezione adeguati e garantendo un’adeguata ventilazione per ridurre al minimo i rischi per la salute e la sicurezza.
| Simboli di pericolo | Corrosivo, Pericoloso per la salute, Tossico acuto |
| Descrizione della sicurezza | – Molto tossico – Corrosivo – Provoca ustioni |
| Numeri di identificazione delle Nazioni Unite | ONU 3086 (classe 6.1) |
| Codice SA | 2841.10.10 |
| Classe di pericolo | 6.1 (Sostanze tossiche) |
| Gruppo di imballaggio | III |
| Tossicità | Tossicità orale acuta: Molto tossico<br>Tossicità cronica: Potenziale cancerogeno |
Nota: i simboli di pericolo utilizzati nella tabella sono simboli internazionali comunemente riconosciuti. È importante fare riferimento alle normative specifiche e alle istruzioni di sicurezza per informazioni complete sulla manipolazione e lo stoccaggio del bicromato di potassio.
Metodi di sintesi del dicromato di potassio
Esistono diversi metodi per sintetizzare il dicromato di potassio. Un metodo comunemente utilizzato prevede la reazione tra cromato di potassio (K2CrO4) e acido cromico (H2CrO4) . La reazione avviene in un ambiente acido, solitamente con acido solforico (H2SO4) come catalizzatore. La reazione può riassumere tutto.
2K2CrO4 + 2H2CrO4 + 2H2SO4 → K2Cr2O7 + Cr2(SO4)3 + 4H2O
Un altro metodo prevede l’ossidazione del cromato di potassio utilizzando un forte agente ossidante, come l’acido solforico concentrato (H2SO4) , e un agente riducente, come l’etanolo (C2H5OH). La reazione può riassumere tutto.
2K2CrO4 + H2SO4 + 3C2H5OH → K2Cr2O7 + Cr2(SO4)3 + 7H2O + 3CO2
L’idrossido di potassio (KOH) reagisce con il triossido di cromo (CrO3) in un mezzo acquoso per produrre dicromato di potassio. In un mezzo acquoso, la reazione avviene. La reazione può riassumere tutto.
2KOH + CrO3 → K2Cr2O7 + H2O
Questi metodi di sintesi richiedono adeguate precauzioni di sicurezza a causa della natura tossica e corrosiva dei reagenti coinvolti. È importante eseguire queste reazioni in un’area ben ventilata, indossare dispositivi di protezione e maneggiare con attenzione le sostanze chimiche. Inoltre, seguire adeguati protocolli di smaltimento dei rifiuti è essenziale per ridurre al minimo l’impatto ambientale.
Usi del bicromato di potassio
Il bicromato di potassio trova applicazioni in vari campi grazie alle sue proprietà uniche. Ecco alcuni dei suoi usi comuni:
- Agente ossidante: le reazioni chimiche utilizzano ampiamente il dicromato di potassio come forte agente ossidante per ossidare gli alcoli in aldeidi o chetoni.
- Reagente di laboratorio: la chimica analitica utilizza il dicromato di potassio come reagente per test ed esperimenti, inclusa la determinazione di composti organici e l’esecuzione di reazioni redox.
- Industria conciaria: l’industria della pelle utilizza il dicromato di potassio come agente conciante per trattare le pelli di animali e trasformarle in prodotti in pelle durevoli.
- Fotografia: la fotografia in bianco e nero incorpora il dicromato di potassio nelle soluzioni di sviluppo e lo utilizza per sensibilizzare le emulsioni per ottenere effetti fotografici specifici.
- Conservazione del legno: per proteggere il legno da marciume, funghi e attacchi di insetti, l’industria della conservazione del legno utilizza il dicromato di potassio come conservante del legno altamente tossico.
- Produzione di pigmenti: il dicromato di potassio svolge un ruolo vitale nella produzione di pigmenti come il giallo cromo e l’arancione cromo, che le industrie utilizzano in vernici, inchiostri e coloranti.
- Galvanotecnica: i processi di galvanoplastica utilizzano il dicromato di potassio per fornire un rivestimento decorativo e resistente alla corrosione su metalli tra cui zinco, alluminio e ottone.
- Pirotecnica: il dicromato di potassio svolge un ruolo essenziale nelle miscele pirotecniche, fornendo colori arancioni brillanti a fuochi d’artificio e razzi.
- Industria tessile: la tintura e la stampa dei tessuti incorporano dicromato di potassio per ottenere i colori desiderati e migliorare la solidità del colore.
- Calibrazione della vetreria da laboratorio: per misurazioni precise del volume, le soluzioni di dicromato di potassio vengono utilizzate per calibrare la vetreria da laboratorio.
Queste diverse applicazioni evidenziano la versatilità e l’importanza del dicromato di potassio in vari settori e attività scientifiche.
Domande:
D: Qual è la formula corretta per il dicromato di potassio?
R: La formula corretta per il dicromato di potassio è K2Cr2O7.
D: Cos’è il dicromato di potassio?
R: Il dicromato di potassio è un composto chimico di colore arancione brillante ed è comunemente usato come agente ossidante.
D: Il dicromato di potassio è ionico o covalente?
R: Il dicromato di potassio è un composto ionico.
D: Qual è la quantità minima di acqua necessaria per sciogliere 3 moli di bicromato di potassio?
R: La quantità minima di acqua necessaria per sciogliere 3 moli di bicromato di potassio è di circa 564 grammi.
D: Qual è la massa molare del dicromato di potassio?
R: La massa molare del dicromato di potassio è 294,18 grammi per mole (g/mol).
D: Scheda di sicurezza del bicromato di potassio?
R: Le schede tecniche sulla sicurezza dei materiali (MSDS) per il dicromato di potassio forniscono informazioni dettagliate sui pericoli, sulla manipolazione, sullo stoccaggio e sulle misure di primo soccorso. Fare riferimento a fonti o produttori affidabili per la scheda di sicurezza specifica.
D: Come viene preparato il dicromato di potassio dal minerale di cromite?
R: Il dicromato di potassio può essere preparato dal minerale di cromite arrostendolo con idrossido di potassio o carbonato di potassio e quindi isolando il prodotto.
D: Quanti grammi di bicromato di potassio sono stati aggiunti al matraccio tarato?
R: Il numero esatto di grammi di bicromato di potassio aggiunti al matraccio tarato dipende dalla concentrazione e dal volume desiderati della soluzione.
D: Come distingueresti tra propanale e propanone utilizzando il dicromato di potassio acidificato?
R: Il propanale verrebbe ossidato in acido propanoico dal dicromato di potassio acidificato, mentre il propanone (acetone) non mostrerebbe alcuna reazione.
D: Il dicromato di potassio è un agente riducente?
R: No, il dicromato di potassio è un agente ossidante.
D: Come scrivere la formula per il dicromato di potassio?
R: La formula del dicromato di potassio è K2Cr2O7.
