L’acido cloroacetico è un composto chimico con la formula CH₂ClCOOH. Viene utilizzato in varie applicazioni industriali, inclusa la produzione di coloranti, prodotti farmaceutici ed erbicidi.
| Nome IUPAC | Acido cloroacetico |
| Formula molecolare | CH₂ClCOOH |
| numero CAS | 79-11-8 |
| Sinonimi | Acido monocloroacetico, MCA, acido cloroetanoico, acido cloroetilico |
| InChI | InChI=1S/C2H3ClO2/c3-1-2(4)5/h1H2,(H,4,5) |
Proprietà dell’acido cloroacetico
Formula dell’acido cloroacetico
La formula dell’acido cloroacetico è CH₂ClCOOH. È costituito da due atomi di carbonio, tre atomi di idrogeno, un atomo di cloro e due atomi di ossigeno. L’atomo di cloro è legato a uno degli atomi di carbonio, mentre l’altro atomo di carbonio è legato al gruppo dell’acido carbossilico (-COOH).
Massa molare dell’acido cloroacetico
La massa molare dell’acido monocloroacetico si calcola sommando le masse atomiche dei suoi elementi costitutivi. L’acido monocloroacetico ha una massa molare di circa 94,5 grammi per mole. Si determina considerando le masse atomiche di carbonio (C), idrogeno (H), cloro (Cl) e ossigeno (O) presenti nel composto.
Punto di ebollizione dell’acido cloroacetico
L’acido monocloroacetico ha un punto di ebollizione di circa 189 gradi Celsius. A questa temperatura, l’acido monocloroacetico liquido si trasforma nella fase gassosa. Il punto di ebollizione dell’acido monocloroacetico è influenzato dalle forze intermolecolari tra le sue molecole e dalla pressione atmosferica.
Punto di fusione dell’acido cloroacetico
Il punto di fusione dell’acido monocloroacetico è di circa 62 gradi Celsius. Questa è la temperatura alla quale la forma solida dell’acido monocloroacetico passa allo stato liquido. Il punto di fusione può variare leggermente a seconda della purezza del campione e delle condizioni in cui viene misurato.
Densità dell’acido cloroacetico g/mL
La densità dell’acido monocloroacetico è di circa 1,58 grammi per millilitro. Indica la massa di acido monocloroacetico per unità di volume. La densità dell’acido monocloroacetico è influenzata da fattori quali temperatura e pressione.
Peso molecolare dell’acido cloroacetico
Il peso molecolare dell’acido monocloroacetico è di circa 94,5 grammi per mole. Rappresenta la somma dei pesi atomici di tutti gli atomi presenti in una molecola di acido monocloroacetico. Il peso molecolare è utile in vari calcoli che coinvolgono il composto, come determinare concentrazioni o quantità molari.
Struttura dell’acido cloroacetico
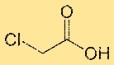
L’acido monocloroacetico ha una struttura costituita da un atomo di carbonio centrale legato a un atomo di cloro, un gruppo di acido carbossilico (-COOH) e due atomi di idrogeno. L’atomo di cloro è direttamente legato all’atomo di carbonio. La disposizione strutturale dell’acido monocloroacetico influenza le sue proprietà chimiche e la sua reattività.
Solubilità dell’acido cloroacetico
L’acido monocloroacetico è moderatamente solubile in acqua. Forma legami idrogeno con le molecole d’acqua, permettendole di dissolversi in una certa misura. La solubilità dell’acido monocloroacetico è influenzata da fattori quali temperatura, pH e presenza di altre sostanze nella soluzione.
| Aspetto | Liquido incolore |
| Peso specifico | 1,58 g/ml |
| Colore | Incolore |
| Odore | Aceto |
| Massa molare | 94,5 g/mole |
| Densità | 1,58 g/ml |
| Punto di fusione | 62°C |
| Punto di ebollizione | 189°C |
| Punto flash | 111°C |
| solubilità in acqua | Miscibile |
| Solubilità | Solubile in etanolo, etere, cloroformio |
| Pressione del vapore | 0,23 mmHg a 25°C |
| Densità del vapore | 3.3 (aria = 1) |
| pKa | 2.87 |
| pH | 1,5 – 2,5 |
Sicurezza e pericoli dell’acido cloroacetico
L’acido monocloroacetico presenta diversi rischi per la sicurezza e deve essere maneggiato con cautela. È corrosivo per la pelle, gli occhi e il sistema respiratorio, provocando ustioni e irritazioni. Il contatto diretto può causare gravi danni alla pelle e agli occhi. L’inalazione dei suoi vapori o nebbie può irritare le vie respiratorie. È dannoso anche se ingerito, causando disturbi gastrointestinali. Quando si lavora con l’acido monocloroacetico è necessario indossare dispositivi di protezione individuale adeguati, come guanti e occhiali protettivi. Una ventilazione adeguata è fondamentale per ridurre al minimo l’esposizione. In caso di contatto con la pelle o gli occhi, è essenziale sciacquare immediatamente con acqua e consultare un medico.
| Simboli di pericolo | Corrosivo, tossico |
| Descrizione della sicurezza | Evita il contatto. Utilizzare dispositivi di protezione individuale. Garantire una ventilazione adeguata. Maneggiare con cura. |
| Numeri di identificazione delle Nazioni Unite | ONU 1751 |
| Codice SA | 2915.12.00 |
| Classe di pericolo | 8 (Corrosivo) |
| Gruppo di imballaggio | II |
| Tossicità | Tossico per ingestione, inalazione e assorbimento cutaneo. Provoca gravi ustioni e lesioni oculari. Nocivo se ingerito. |
Metodi per la sintesi dell’acido cloroacetico
Vari metodi consentono la sintesi dell’acido monocloroacetico.
Un metodo comunemente usato per sintetizzare l’acido monocloroacetico prevede il trattamento dell’acido acetico con un agente alogenante, solitamente cloro gassoso (Cl₂), in presenza di un catalizzatore come l’acido solforico (H₂SO₄). La reazione tra acido acetico e cloro comporta la sostituzione di un atomo di idrogeno nella molecola di acido acetico con un atomo di cloro, formando così acido monocloroacetico.
Un altro metodo prevede la reazione tra cloruro di acetile (CH₃COCl) e acqua (H₂O). L’acqua idrolizza il cloruro di acetile, portando alla formazione di acido monocloroacetico. Questa reazione è esotermica e richiede cautela quando viene eseguita.
La formazione dell’acido monocloroacetico avviene attraverso la carbossilazione del clorometano (CH₃Cl) utilizzando anidride carbonica (CO₂) in presenza di una base robusta come l’idrossido di sodio (NaOH) . La reazione procede per sostituzione nucleofila, dove il gruppo carbossilato (-COOH) della molecola di anidride carbonica sostituisce lo ione cloruro.
Ricordare che una corretta manipolazione e precauzioni di sicurezza sono cruciali per questi metodi di sintesi a causa della natura corrosiva e tossica dell’acido monocloroacetico. Garantire un attento controllo delle condizioni di reazione e il corretto smaltimento dei sottoprodotti e dei rifiuti per garantire processi di sintesi sicuri ed efficienti.
Usi dell’acido cloroacetico
L’acido monocloroacetico trova applicazioni in vari settori grazie alle sue proprietà versatili. Ecco alcuni usi comuni:
- Produzione di erbicidi: l’acido monocloroacetico è un ingrediente essenziale nella sintesi di erbicidi, come il glifosato. Aiuta a inibire la crescita di piante ed erbe infestanti indesiderate in agricoltura.
- Produzione farmaceutica: funge da elemento fondamentale nella produzione di composti farmaceutici, inclusi antibiotici, antisettici e analgesici. L’acido monocloroacetico aiuta a modificare e migliorare le proprietà desiderate di questi farmaci.
- Industria dei coloranti e dei pigmenti: i produttori utilizzano l’acido monocloroacetico nella produzione di coloranti e pigmenti. Aiuta nella sintesi dei coloranti utilizzati nei tessuti, nelle vernici, negli inchiostri e in altre applicazioni decorative.
- Intermedi chimici: agisce come un composto intermedio chiave nella produzione di vari prodotti chimici. La sintesi di polimeri, solventi, plastificanti e altri composti organici prevede l’utilizzo di questi intermedi.
- Produzione di tensioattivi: l’acido monocloroacetico svolge un ruolo nella produzione di tensioattivi, che sono componenti essenziali di detergenti, detergenti e prodotti per la cura personale. I tensioattivi aiutano a ridurre la tensione superficiale tra i liquidi, consentendo migliori capacità di miscelazione e dispersione.
- Applicazioni di ricerca e di laboratorio: i laboratori di ricerca utilizzano l’acido monocloroacetico come reagente per reazioni chimiche, in particolare nella sintesi organica e nelle procedure analitiche.
- Reazioni chimiche e sintesi organica: funge da importante reagente in varie reazioni organiche, come sostituzioni nucleofile, esterificazioni e reazioni di carbossilazione.
- Galvanotecnica: l’acido monocloroacetico trova applicazione nei processi galvanici, dove funge da fonte di cloro per la deposizione di rivestimenti metallici sulle superfici.
Queste diverse applicazioni evidenziano l’importanza dell’acido monocloroacetico in tutti i settori, contribuendo allo sviluppo di numerosi prodotti e processi chimici.
Domande:
D: Qual è il valore Ka per una soluzione 0,15 M di acido cloroacetico con un pH di 1,86?
R: Il valore Ka dell’acido monocloroacetico può essere calcolato utilizzando il valore del pH ed è circa 1,4 x 10^-3.
D: L’acido cloroacetico è forte o debole?
R: L’acido monocloroacetico è un acido debole.
D: Cosa danno il 4-clorofenolato di sodio + acido cloroacetico?
R: La reazione del 4-clorofenolato di sodio con l’acido monocloroacetico dà acido 4-clorofenossiacetico e cloruro di sodio.
D: Qual è la Ka dell’acido cloroacetico?
R: Il valore Ka dell’acido monocloroacetico è circa 1,4 x 10^-3.
D: L’acido cloroacetico è monoprotico?
R: Sì, l’acido monocloroacetico è monoprotico, il che significa che può cedere solo un protone (ione H+) in una reazione chimica.
D: Qual è la costante di ionizzazione dell’acido cloroacetico?
R: La costante di ionizzazione (Ka) dell’acido monocloroacetico è circa 1,4 x 10^-3.
D: L’acido cloroacetico è più forte dell’acido acetico?
R: Sì, l’acido monocloroacetico è più forte dell’acido acetico.
D: Perché l’acido cloroacetico è più forte dell’acido acetico?
R: La presenza dell’atomo di cloro nell’acido monocloroacetico aumenta la sua capacità di attrazione degli elettroni, rendendolo più acido dell’acido acetico.
D: Qual è la massa molare dell’acido cloroacetico?
R: La massa molare dell’acido monocloroacetico è di circa 94,5 grammi per mole.
