L’isoprene (C5H8) è un composto organico naturale utilizzato nella produzione di gomma, plastica e altri materiali. Svolge un ruolo cruciale nella formazione di ozono e nell’inquinamento atmosferico.
| Nome IUPAC | 2-metilbuta-1,3-diene |
| Formula molecolare | C₅H₈ |
| numero CAS | 78-79-5 |
| Sinonimi | Isoprene, 2-metil-1,3-butadiene, β-isoprene |
| InChI | InChI=1S/C₅H₈/c1-4-5(2)3/h4H,1-2H3 |
Proprietà dell’isoprene
Formula dell’isoprene
La formula dell’isoprene è C₅H₈. È composto da cinque atomi di carbonio e otto atomi di idrogeno. La struttura molecolare dell’isoprene è caratterizzata da una catena ramificata con un doppio legame tra il secondo e il terzo atomo di carbonio.
Massa molare dell’isoprene
La massa molare del 2-metil-1,3-butadiene può essere calcolata sommando le masse atomiche dei suoi elementi costitutivi. Il carbonio ha una massa molare di 12,01 g/mol, mentre l’idrogeno ha una massa molare di 1,01 g/mol. Pertanto, la massa molare del 2-metil-1,3-butadiene è di circa 68,12 g/mol.
Punto di ebollizione dell’isoprene
L’isoprene ha un punto di ebollizione di circa 34°C (93°F). Questo punto di ebollizione relativamente basso lo rende volatile e incline all’evaporazione a temperatura ambiente.
Punto di fusione dell’isoprene
Il punto di fusione del 2-metil-1,3-butadiene è di circa -145°C (-229°F). A questa temperatura, il 2-metil-1,3-butadiene passa dallo stato solido a quello liquido.
Densità dell’isoprene g/ml
La densità del 2-metil-1,3-butadiene è di circa 0,69 g/mL. Questo valore rappresenta la massa del 2-metil-1,3-butadiene per unità di volume ed è influenzato dal suo peso molecolare e dalla disposizione strutturale.
Peso molecolare dell’isoprene
Il peso molecolare del 2-metil-1,3-butadiene viene determinato sommando i pesi atomici dei suoi atomi costituenti. Con una formula C₅H₈, il peso molecolare del 2-metil-1,3-butadiene è di circa 68,12 g/mol.
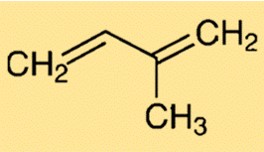
Struttura dell’isoprene
La struttura del 2-metil-1,3-butadiene è caratterizzata da una catena ramificata di cinque atomi di carbonio. Contiene un doppio legame tra il secondo e il terzo atomo di carbonio. Questa struttura conferisce flessibilità e reattività al 2-metil-1,3-butadiene, rendendolo un elemento chiave nella sintesi di vari composti.
Solubilità dell’isoprene
L’isoprene è scarsamente solubile in acqua ma si dissolve facilmente in solventi organici come etanolo e acetone. Le sue caratteristiche di solubilità sono attribuite alla natura non polare della sua struttura molecolare.
Queste note forniscono una panoramica delle proprietà chiave del 2-metil-1,3-butadiene, inclusa la sua formula, massa molare, punto di ebollizione, punto di fusione, densità, peso molecolare, struttura e solubilità. Comprendere queste proprietà è essenziale per studiare e utilizzare il 2-metil-1,3-butadiene in varie applicazioni industriali.
| Aspetto | Liquido incolore |
| Peso specifico | 0,68 – 0,70 g/ml |
| Colore | Incolore |
| Odore | Dolce, piccante |
| Massa molare | 68,12 g/mole |
| Densità | 0,68 – 0,70 g/ml |
| Punto di fusione | -145°C (-229°F) |
| Punto di ebollizione | 34°C (93°F) |
| Punto flash | -40°C (-40°F) |
| solubilità in acqua | Scarsamente solubile |
| Solubilità | Solubile in solventi organici |
| Pressione del vapore | 290 mmHg a 25°C |
| Densità del vapore | 2,49 (aria = 1) |
| pKa | ~40 |
| pH | Neutro |
Sicurezza e pericoli dell’isoprene
L’isoprene o il 2-metil-1,3-butadiene comportano alcuni rischi per la sicurezza che devono essere considerati. È altamente infiammabile e può formare miscele vapore-aria esplosive. Va quindi maneggiato con cautela in prossimità di fiamme libere o fonti di calore. L’esposizione all’isoprene può causare irritazione alla pelle e agli occhi. Il contatto prolungato o ripetuto può provocare dermatiti. L’inalazione dei vapori di 2-metil-1,3-butadiene può causare irritazione respiratoria, vertigini e mal di testa. È importante utilizzare una ventilazione adeguata e dispositivi di protezione individuale quando si lavora con 2-metil-1,3-butadiene. In caso di ingestione è necessaria l’immediata assistenza medica. Si consiglia di conservare il 2-metil-1,3-butadiene in un’area fresca e ben ventilata, lontano da fonti di ignizione.
| Simboli di pericolo | Infiammabile (F), Irritante (Xi) |
| Descrizione della sicurezza | Tenere lontano da fonti di calore/scintille/fiamme libere/superfici calde. Evitare di respirare polvere/fumi/gas/nebbia/vapori/aerosol. Indossare guanti protettivi/proteggere gli occhi/il viso. Conservare in un’area ben ventilata. |
| Numeri di identificazione delle Nazioni Unite | ONU 1214 |
| Codice SA | 2902.41.00 |
| Classe di pericolo | Classe 3 (Liquidi infiammabili) |
| Gruppo di imballaggio | GE II |
| Tossicità | Può causare irritazione alla pelle e agli occhi. Nocivo se ingerito. |
Metodi di sintesi dell’isoprene
Vari metodi possono sintetizzare il 2-metil-1,3-butadiene. Un metodo comune consiste nel crackare termicamente materie prime a base di petrolio, come nafta o gas leggeri, in presenza di catalizzatori. Questo processo produce una miscela di composti, tra cui il 2-metil-1,3-butadiene, che possiamo separare e purificare.
Un altro metodo consiste nel deidrogenare cataliticamente l’isopentano o l’isobutano . In condizioni controllate e con l’aiuto di un catalizzatore, questi idrocarburi subiscono una reazione di deidrogenazione che porta alla produzione di 2-metil-1,3-butadiene.
Possiamo anche ottenere il 2-metil-1,3-butadiene da fonti rinnovabili attraverso vie biologiche. Modificando geneticamente microrganismi come batteri e lieviti, consentiamo loro di produrre 2-metil-1,3-butadiene attraverso le vie metaboliche. Questo approccio offre un’alternativa sostenibile ed ecologica ai metodi di sintesi tradizionali.
Inoltre, la pirolisi della biomassa, un processo termochimico, può generare 2-metil-1,3-butadiene e altre sostanze chimiche preziose. Sottoponendo i materiali della biomassa ad alte temperature in assenza di ossigeno si decompongono i composti organici complessi nella biomassa, rilasciando 2-metil-1,3-butadiene come uno dei prodotti risultanti.
Nel complesso, la sintesi del 2-metil-1,3-butadiene comprende una serie di metodi, tra cui cracking termico, deidrogenazione catalitica, percorsi biologici e pirolisi della biomassa. Questi vari approcci contribuiscono alla disponibilità del 2-metil-1,3-butadiene per varie applicazioni industriali tenendo conto degli aspetti ambientali e sostenibili.
Usi dell’isoprene
L’isoprene svolge un ruolo cruciale in vari settori grazie alle sue proprietà e reattività uniche. Trova numerose applicazioni nei seguenti ambiti:
- Produzione di gomma: i produttori utilizzano il 2-metil-1,3-butadiene come monomero essenziale per produrre gomma sintetica, tra cui poli2-metil-1,3-butadiene e gomma stirene-butadiene (SBR). Usano queste gomme per realizzare pneumatici, nastri trasportatori, tubi e vari prodotti in gomma stampata.
- Produzione di polimeri: l’isoprene funge da elemento base nella produzione di varie resine polimeriche ed elastomeri. Le industrie lo utilizzano per sintetizzare elastomeri termoplastici, adesivi, rivestimenti e sigillanti.
- Intermedi chimici: l’isoprene si rivela versatile come intermedio chimico nella produzione di un’ampia gamma di prodotti chimici. Facilita la sintesi di prodotti farmaceutici, fragranze, aromi, antiossidanti e altri prodotti chimici speciali.
- Formazione di ozono: l’isoprene contribuisce in modo significativo alla chimica atmosferica reagendo con gli ossidi di azoto (NOx) e la luce solare per formare ozono. Questo processo influisce sulla qualità dell’aria e contribuisce alla formazione dello smog.
- Additivo per carburante: le industrie utilizzano il 2-metil-1,3-butadiene come additivo per carburante per migliorare l’efficienza di combustione e le caratteristiche prestazionali della benzina. Migliora il numero di ottani e riduce i colpi del motore.
- Ricerca e sviluppo: l’isoprene svolge un ruolo importante negli studi di ricerca e sviluppo, in particolare nei campi della chimica, della scienza dei materiali e delle scienze ambientali. I ricercatori lo utilizzano ampiamente come strumento prezioso per studiare nuove reazioni, sviluppare materiali innovativi e studiare la chimica dell’atmosfera.
Le diverse applicazioni del 2-metil-1,3-butadiene evidenziano la sua importanza in molteplici settori, che vanno dalla produzione della gomma alla sintesi chimica, svolgendo anche un ruolo nella ricerca ambientale e scientifica.
Domande:
D: Qual è la regola dell’isoprene?
R: La regola del 2-metil-1,3-butadiene afferma che molti composti naturali possono derivare dal 2-metil-1,3-butadiene, che è composto da cinque atomi di carbonio e ha una struttura ramificata.
D: Quante unità di isoprene ci sono nell’alfa-ylangen?
R: L’alfa-ylangen contiene tre unità di 2-metil-1,3-butadiene perché ha una catena lineare di 15 atomi di carbonio derivata da tre elementi costitutivi del 2-metil-1,3-butadiene.
D: Quante unità di isoprene vengono utilizzate per sintetizzare una molecola di colesterolo?
R: La sintesi di una molecola di colesterolo richiede 18 unità di 2-metil-1,3-butadiene, che vengono combinate e modificate attraverso una serie di reazioni enzimatiche.
D: Quante unità di isoprene ci sono nel colesterolo?
R: Il colesterolo contiene quattro anelli fusi ed è composto da 30 unità di 2-metil-1,3-butadiene.
D: Come posso identificare le unità di isoprene?
R: Le unità 2-metil-1,3-butadiene possono essere identificate dalla loro struttura caratteristica, costituita da una catena ramificata di cinque atomi di carbonio con un doppio legame tra il secondo e il terzo atomo di carbonio.
D: Qual è la posizione del gruppo mentilico sull’isoprene?
R: Il gruppo mentilico si trova solitamente al quarto atomo di carbonio di un’unità 2-metil-1,3-butadiene.
D: L’anello a 4 carboni è realizzato in isoprene?
R: No, un anello a 4 atomi di carbonio non è 2-metil-1,3-butadiene. Il 2-metil-1,3-butadiene si riferisce a una specifica unità a cinque atomi di carbonio con una struttura ramificata e un doppio legame.
D: Quante unità di isoprene ci sono nello squalene?
R: Lo squalene, un triterpene, è composto da sei unità di 2-metil-1,3-butadiene, risultanti in una molecola di 30 atomi di carbonio.
