L’EDTA è un amminoacido policarbossilico che può chelare gli ioni metallici. Ha la formula [CH2N(CH2CO2H)2]2. Aiuta ad eliminare i metalli pesanti dal corpo. L’EDTA conserva anche campioni di sangue e prodotti alimentari.
| Nome Iupac | 2,2′,2″,2″‘-(etano-1,2-diildiammoniaca)tetraacetato disodico |
| Formula molecolare | C10H14N2Na2O8 |
| numero CAS | 139-33-3 |
| Sinonimi | Sale disodico dell’acido (etiledinitrilo)tetraacetico, edetato disodico, EDTA disodico, edetato disodico, EDTA disodico, sale disodico dell’EDTA, sale disoide dell’etilenebis (acido imminodiacetico), N,N’-1,2-etandiilbis [N-(carbossimetil )glicina], sale disodico, Na2-EDTA, Na2H2EDTA |
| Inchi | InChI=1S/C10H16N2O8.2Na/c13-7(14)3-11(4-8(15)16)1-2-12(5-9(17)18)6-10(19)20;;/ h1-6H2,(H,13,14)(H,15,16)(H,17,18)(H,19,20);;/q;2*+1/p-2 |
Proprietà dell’EDTA
Formula dell’EDTA
EDTA sta per acido etilendiamminotetraacetico, che è un composto organico sintetico in grado di chelare gli ioni metallici. La formula dell’EDTA è C10H16N2O8, il che significa che contiene 10 atomi di carbonio, 16 atomi di idrogeno, 2 atomi di azoto e 8 atomi di ossigeno nella sua molecola.
Massa molare EDTA
La massa molare del disodio edetato è la somma delle masse atomiche di tutti gli atomi nella sua formula. Le masse atomiche di carbonio, idrogeno, azoto e ossigeno sono rispettivamente 12,01 g/mol, 1,01 g/mol, 14,01 g/mol e 16,00 g/mol. . Pertanto, la massa molare del disodio edetato è (10 x 12,01) + (16 x 1,01) + (2 x 14,01) + (8 x 16,00) = 292,24 g/mol.
Punto di ebollizione dell’EDTA
Il punto di ebollizione di una sostanza è la temperatura alla quale essa passa dallo stato liquido a quello gassoso. Il punto di ebollizione del disodio edetato non è facile da misurare perché si decompone prima di raggiungere il punto di ebollizione. Tuttavia, alcune fonti stimano che il punto di ebollizione del disodio edetato sia di circa 614,2 °C ad una pressione di 760 mmHg.
EDTA Punto di fusione
Il punto di fusione di una sostanza è la temperatura alla quale essa passa da solida a liquida. Il punto di fusione del disodio edetato dipende dal grado di idratazione e cristallizzazione. La forma anidra del disodio edetato ha un punto di fusione di circa 240°C, mentre la forma diidrata ha un punto di fusione di circa 248°C.
EDTA Densità g/ml
La densità di una sostanza è la massa per unità di volume. La densità del disodio edetato varia anche a seconda del grado di idratazione e cristallizzazione. La forma anidra del disodio edetato ha una densità di circa 0,86 g/ml, mentre la forma diidrata ha una densità di circa 1,6 g/ml.
Peso molecolare dell’EDTA
Il peso molecolare di una sostanza è un altro termine per la sua massa molare, che è la massa di una mole della sostanza. Come accennato in precedenza, la massa molare del disodio edetato è 292,24 g/mol, quindi anche il suo peso molecolare è 292,24 g/mol.
Struttura dell’EDTA
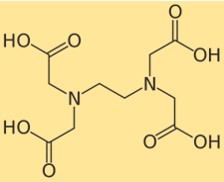
La struttura del disodio edetato mostra come i suoi atomi sono disposti e legati nella sua molecola. Il disodio edetato ha un gruppo etilendiamminico centrale con quattro gruppi di acido carbossilico attaccati. Ciascun gruppo di acido carbossilico può perdere un protone e formare una carica negativa, che può legarsi a uno ione metallico. La struttura del disodio edetato può essere rappresentata dal seguente diagramma:
Solubilità dell’EDTA
La solubilità di una sostanza è la quantità che può dissolversi in un dato solvente ad una data temperatura e pressione. La solubilità del disodio edetato dipende dal pH e dalla presenza di ioni metallici nella soluzione. Il disodio edetato è più solubile nelle soluzioni alcaline che in quelle acide perché forma più cariche negative che possono interagire con le molecole d’acqua. Il disodio edetato può anche formare complessi con ioni metallici, che possono aumentare o diminuire la sua solubilità a seconda della stabilità e della carica del complesso. Ad esempio, a pH 7 e 25 °C, la solubilità del disodio edetato in acqua è di circa 0,5 M (186 mg/ml), mentre la solubilità del suo complesso di calcio è di circa 0,02 M (7 mg/ml).
| Aspetto | Solido cristallino bianco |
| Densità specifica | Non disponibile |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 292,24 g/mole |
| Densità | 1,6 g/ml (diidrato), 0,86 g/ml (anidro) |
| Punto di fusione | 248°C (diidrato), 240°C (anidro) |
| Punto di ebollizione | 614,2°C (si decompone) |
| Punto flash | 325,2°C |
| solubilità in acqua | 0,5 M (186 mg/ml) a pH 7 e 25 °C |
| Solubilità | Solubile in soluzioni alcaline, insolubile in solventi organici |
| Pressione del vapore | 3,77 x 10^-12 mmHg a 25°C |
| Densità del vapore | Non disponibile |
| pKa | 2.0, 2.7, 6.2, 10.3 |
| pH | Da 4 a 6 (soluzione 0,26 M) |
Rischi per la sicurezza dell’EDTA
Il disodio edetato è un composto organico sintetico che può chelare gli ioni metallici. Le sue applicazioni sono molteplici nei campi della medicina, dell’industria, dell’agricoltura e della ricerca. Tuttavia, se non gestiti correttamente, comportano anche alcuni rischi per la salute umana e per l’ambiente.
Il disodio edetato può irritare la pelle e gli occhi se entra in contatto con essi. Se ingerito può anche causare nausea, vomito, diarrea e dolori addominali. Può danneggiare il sistema respiratorio se inalato. Può colpire le cellule del sangue e i reni se assorbito nel corpo. Può essere fatale a dosi elevate.
Il disodio edetato può anche contaminare il suolo e l’acqua se rilasciato nell’ambiente. Può legarsi ai metalli essenziali e influenzarne la disponibilità per piante e animali. Può interferire con i processi biologici che dipendono dagli ioni metallici.
Utilizzare il disodio edetato con cautela e con adeguati dispositivi di protezione. Conservarlo in un luogo fresco, asciutto e ben ventilato. Smaltirlo secondo le normative locali.
| Simboli di pericolo | |
| Descrizione della sicurezza | S24/25: Evitare il contatto con la pelle e gli occhi |
| Numeri di identificazione delle Nazioni Unite | UN3077 (solido), UN3082 (liquido) |
| Codice SA | 29224985 |
| Classe di pericolo | 9 (materiali vari pericolosi) |
| Gruppo di imballaggio | III (pericolo basso) |
| Tossicità | LD50 orale ratto: 2000 mg/kg |
Metodi di sintesi dell’EDTA
Esistono diversi metodi per sintetizzare il disodio edetato, ma il più comune è la condensazione dell’etilendiammina con acido cloroacetico o il suo sale sodico.
La reazione prevede due fasi: in primo luogo, l’attacco nucleofilo dell’etilendiammina sull’acido cloroacetico o sul suo sale sodico forma un intermedio monoammidico. In secondo luogo, la rimozione dell’acido cloridrico o del cloruro di sodio forma un gruppo acido carbossilico. Per formare edetato disodico, può essere fatto reagire con un altro equivalente di acido cloroacetico o il suo sale sodico.
Un altro metodo per sintetizzare il disodio edetato è l’ossidazione dell’etilendiammina con ipoclorito di sodio in una soluzione alcalina. Questo metodo produce disodio edetato come sale di sodio e ammoniaca come sottoprodotto.
Altri metodi per sintetizzare l’edetato disodico includono la reazione dell’etilendiammina con formaldeide e cianuro di sodio o la reazione dell’etilendiammina con acido gliossilico o suoi esteri.
Usi dell’EDTA
Il disodio edetato è un composto organico sintetico che può chelare gli ioni metallici. Ha vari usi in diversi campi e industrie. Alcuni degli usi di Edetate Disodium sono:
- In medicina, il disodio edetato può trattare l’avvelenamento da metalli pesanti legandosi ai metalli tossici e rimuovendoli dal corpo. Può anche prevenire la formazione di coaguli di sangue e la calcificazione delle arterie chelando gli ioni calcio.
- Negli alimenti e nelle bevande, il disodio edetato può preservare il colore, il sapore e la consistenza dei prodotti prevenendo l’ossidazione e l’irrancidimento. Può anche prevenire lo scolorimento e il deterioramento causati dagli ioni metallici.
- Nei cosmetici e nella cura personale, il disodio edetato può migliorare la stabilità e l’efficacia dei prodotti prevenendo la crescita microbica e le reazioni catalizzate dai metalli. Può anche migliorare l’aspetto dei prodotti chelando i minerali responsabili della durezza dell’acqua.
- Nell’industria e nella ricerca, il disodio edetato può migliorare le prestazioni e la qualità di prodotti e processi chelando gli ioni metallici interferenti. Ad esempio, può prevenire la formazione di calcare nelle caldaie e nelle tubazioni, migliorare la tintura e la stampa dei tessuti, rimuovere ruggine e macchie dai metalli e controllare il pH e la concentrazione dei metalli nei metodi analitici.
Domande:
D: Cos’è l’EDTA?
R: Il disodio edetato è un composto organico sintetico che può chelare gli ioni metallici. Sta per acido etilendiamminotetraacetico.
D: Come preparare una soluzione EDTA?
R: Per preparare una soluzione disodica edetata, pesare la quantità desiderata di disodio edetato e scioglierla in acqua distillata. Regolare il pH a 8,0 con idrossido di sodio.
D: Come dissolvere l’EDTA in acqua?
R: Il disodio edetato è solubile in acqua, ma si dissolve lentamente. Per sciogliere il disodio edetato in acqua, riscaldare l’acqua a circa 80°C e mescolare la miscela fino a quando il disodio edetato si dissolve completamente.
D: Come preparare 0,5M EDTA?
R: Per preparare 0,5 M disodico edetato, pesare 73,06 g di disodico edetato e scioglierlo in 800 ml di acqua distillata. Regolare il pH a 8,0 con idrossido di sodio e diluire la soluzione a 1 L con acqua distillata.
D: Cosa fa l’EDTA?
R: Il disodio edetato si lega agli ioni metallici e forma con essi complessi stabili. Ciò impedisce agli ioni metallici di reagire con altre sostanze o di interferire con i metodi analitici.
D: Cosa significa EDTA?
R: Edetato disodico significa acido etilendiamminotetraacetico, che è il nome del composto con la formula [CH2N(CH2CO2H)2]2.
D: Come calcolare la durezza dell’acqua mediante titolazione con EDTA?
R: Per calcolare la durezza dell’acqua mediante titolazione di sodio edetato, titolare un volume noto di campione d’acqua con una soluzione standard di sodio edetato utilizzando un indicatore appropriato. Registrare il volume di disodio edetato utilizzato e utilizzare la seguente formula: Durezza (mg/L come CaCO3) = (Volume di EDTA x Molarità di EDTA x 1000) / Volume del campione di acqua
