Il solfato di ammonio ((NH4)2SO4) è un fertilizzante ampiamente utilizzato che fornisce nutrienti essenziali alle piante. Viene utilizzato anche nei ritardanti di fiamma, nella purificazione delle proteine e come additivo alimentare.
| Nome dell’IUPAC | Tetraossosolfato di ammonio (VI) |
| Formula molecolare | (NH4)2SO4 |
| numero CAS | 7783-20-2 |
| Sinonimi | Solfato di ammonio, solfato di ammonio (2:1), solfato di ammonio, sale di ammonio dell’acido solforico, mascagnite, Actamaster, Dolamin |
| InChI | InChI=1S/2H3N.H2O4S/c;;1-5(2,3)4/h2*1H3;(H2,1,2,3,4) |
Proprietà del solfato di ammonio
Formula di solfato di ammonio
La formula del solfato di ammonio è (NH4)2SO4. Ciò significa che una molecola di solfato di ammonio contiene due ioni ammonio (NH4)+ e uno ione solfato (SO4)2-. Gli ioni ammonio e lo ione solfato sono tenuti insieme da legami ionici.
Massa molare del solfato di ammonio
La massa molare di (NH4)2SO4 è 132,14 g/mol. Per calcolare la massa molare, dobbiamo sommare le masse atomiche di tutti gli atomi nella formula. Le masse atomiche sono:
- Azoto: 14,01 g/mol
- Idrogeno: 1,01 g/mol
- Zolfo: 32,06 g/mol
- Ossigeno: 16,00 g/mol
Pertanto, la massa molare di (NH4)2SO4 è:
(2 x 14,01) + (8 x 1,01) + 32,06 + (4 x 16,00) = 132,14 g/mol
Punto di ebollizione del solfato di ammonio
Il punto di ebollizione di (NH4)2SO4 non è ben definito perché si decompone prima di raggiungere il punto di ebollizione. Quando riscaldato oltre i 235°C, (NH4)2SO4 inizia a perdere acqua e formare bisolfato di ammonio (NH4)HSO4. Quando riscaldato a temperature superiori a 280°C, il bisolfato di ammonio si decompone ulteriormente in ammoniaca (NH3) e acido solforico (H2SO4).
Solfato di ammonio Punto di fusione
Il punto di fusione di (NH4)2SO4 è 235°C. Questa è la temperatura alla quale (NH4)2SO4 passa da solido a liquido. Tuttavia, come accennato in precedenza, anche (NH4)2SO4 inizia a decomporsi a questa temperatura, quindi non è una fase liquida pura.
Densità del solfato di ammonio g/ml
La densità di (NH4)2SO4 è 1,77 g/ml a temperatura e pressione ambiente. Ciò significa che un millilitro di (NH4)2SO4 pesa 1,77 grammi. La densità di una sostanza dipende dalla sua temperatura e pressione, quindi può variare leggermente in condizioni diverse.
Peso molecolare del solfato di ammonio
Il peso molecolare di (NH4)2SO4 è uguale alla sua massa molare, che è 132,14 g/mol. Il peso molecolare è la massa di una mole di una sostanza, che equivale a 6,022 x 10^23 molecole. Il peso molecolare può anche essere espresso in unità di massa atomica (amu), che equivalgono a 1/12 della massa di un atomo di carbonio-12. In amu, il peso molecolare di (NH4)2SO4 è 132,14 amu.
Struttura del solfato di ammonio
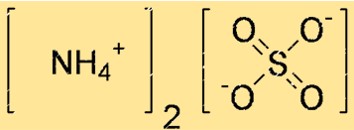
La struttura di (NH4)2SO4 può essere rappresentata da una struttura a punti di Lewis o da un modello ball-and-stick. Una struttura a punti di Lewis mostra gli elettroni di valenza di ciascun atomo e i legami tra di loro. Un modello ball-and-stick mostra la forma e la dimensione di ciascun atomo e i legami tra di loro.
Nella struttura sopra, le linee doppie (=) rappresentano doppi legami, le linee singole (-) rappresentano legami singoli e i punti (.) rappresentano coppie solitarie di elettroni.
Solubilità del solfato di ammonio
La solubilità di (NH4)2SO4 è la quantità di (NH4)2SO4 che può dissolversi in una data quantità di acqua ad una data temperatura. La solubilità di (NH4)2SO4 aumenta con l’aumentare della temperatura, come mostrato nei seguenti dati:
| Temperatura (°C) | Solubilità (g/100 ml di acqua) |
| 0 | 70.6 |
| Aspetto | Granuli o cristalli bianchi igroscopici fini |
| Densità specifica | 1,77 |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 132,14 g/mole |
| Densità | 1,77 g/cm3 |
| Punto di fusione | da 235 a 280°C (si decompone) |
| Punto di ebollizione | Non applicabile (scomposto) |
| Punto flash | Non infiammabile |
| solubilità in acqua | 70,6 g per 100 g di acqua (0°C), 74,4 g per 100 g di acqua (20°C), 103,8 g per 100 g di acqua (100°C) |
| Solubilità | Insolubile in acetone, alcool ed etere |
| Pressione del vapore | Trascurabile |
| Densità del vapore | Non applicabile |
| pKa | 5,5 (per ione ammonio) |
| pH | Da 5 a 6 (per una soluzione al 5%) |
Sicurezza e pericoli del solfato di ammonio
(NH4)2SO4 non è molto pericoloso per la salute umana, ma può causare irritazione alla pelle, agli occhi, al naso e alla gola se contattato o inalato. Se ingerito può anche causare nausea, mal di stomaco, diarrea, vomito e sonnolenza. È dannoso per la vita acquatica e il suo rilascio nell’ambiente dovrebbe essere evitato. Si decompone se riscaldato a temperature superiori a 235°C, formando gas tossici come ammoniaca e acido solforico. È generalmente riconosciuto come sicuro come additivo alimentare, ma in alcune persone può causare reazioni allergiche o sintomi di asma.
| Simboli di pericolo | Non necessario |
| Descrizione della sicurezza | Non disperdere nell’ambiente. Smaltire il contenuto/contenitore in un impianto di smaltimento rifiuti approvato. |
| Numeri di identificazione delle Nazioni Unite | Non applicabile |
| Codice SA | 31022100 |
| Classe di pericolo | Non applicabile |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | LD50 (orale, ratto) = 2.840 mg/kg |
Metodi per la sintesi del solfato di ammonio
(NH4)2SO4 può essere sintetizzato con vari metodi perché è un sale inorganico. Alcuni dei metodi comuni sono:
- Neutralizzazione dell’ammoniaca e dell’acido solforico: questo metodo prevede la miscelazione del gas di ammoniaca o di una soluzione acquosa con acido solforico e l’evaporazione dell’acqua per ottenere cristalli (NH4)2SO4.
2NH3 + H2SO4 -> (NH4)2SO4
- Reazione del carbonato di ammonio e del gesso: questo metodo prevede l’aggiunta di gesso finemente suddiviso ( solfato di calcio ) a una soluzione di carbonato di ammonio e il filtraggio del precipitato di carbonato di calcio.
(NH4)2CO3 + CaSO4 -> (NH4)2SO4 + CaCO3
- Sottoprodotto di altri processi: vari processi industriali, come la purificazione dei gas di cokeria, la produzione di caprolattame, la raffinazione del nichel e la desolforazione dei gas di scarico, possono produrre (NH4)2SO4 come sottoprodotto. Questi processi utilizzano ammoniaca o composti di ammonio per rimuovere lo zolfo o altre impurità dai flussi di gas, risultando in (NH4)2SO4 come rifiuto o prodotto prezioso.
Usi del solfato di ammonio
(NH4)2SO4 è un sale inorganico che ha diversi usi, tra cui:
- Fertilizzante alcalino per il terreno: (NH4)2SO4 abbassa il pH del terreno e fornisce azoto e zolfo per la crescita delle piante. È adatto per colture che richiedono terreni acidi, come mirtilli, patate e pomodori.
- Coadiuvante spray agricolo: (NH4)2SO4 migliora l’efficacia di insetticidi, erbicidi e fungicidi idrosolubili legando ioni ferro e calcio che possono interferire con la loro azione. Migliora anche l’assorbimento del glifosato e di altri erbicidi sistemici da parte delle piante.
- Purificazione delle proteine: (NH4)2SO4 può far precipitare le proteine da soluzioni acquose aumentando la forza ionica e riducendo la solubilità delle proteine. Il metodo della salatura può essere utilizzato per separare le proteine in base alla loro dimensione, carica e idrofobicità.
- Additivo alimentare: vari prodotti alimentari come pane, formaggio, vino e verdure in scatola utilizzano (NH4)2SO4 come regolatore di acidità, condizionatore dell’impasto, nutriente del lievito e agente rassodante. La FDA lo riconosce come generalmente sicuro.
- Altri usi: (NH4)2SO4 può essere utilizzato per produrre altri sali di ammonio, estintori, ritardanti di fiamma, concia della pelle, tintura di tessuti, galvanica dei metalli e chimica analitica.
Domande:
D: Qual è la formula chimica del solfato di ammonio?
R: La formula chimica del solfato di ammonio è (NH4)2SO4. Ciò significa che una molecola di solfato di ammonio contiene due ioni ammonio (NH4)+ e uno ione solfato (SO4)2-.
D: Il solfato di ammonio è solubile?
R: (NH4)2SO4 è solubile in acqua, ma insolubile in acetone, alcool ed etere. Può sciogliere 70,6 grammi per 100 grammi di acqua a 0°C, 74,4 grammi per 100 grammi di acqua a 20°C e 103,8 grammi per 100 grammi di acqua a 100°C.
D: Quanto solfato di ammonio per litro d’acqua?
R: La quantità di (NH4)2SO4 per litro d’acqua dipende dalla concentrazione desiderata e dalla temperatura dell’acqua. Ad esempio, se la concentrazione desiderata è 10% (p/v) e la temperatura dell’acqua è 20°C, la quantità di (NH4)2SO4 per litro d’acqua è:
10% (p/v) = 10 grammi per 100 ml di acqua 1 gallone = 3785,41 ml 10 grammi x 3785,41 ml / 100 ml = 378,54 grammi Pertanto, la quantità di (NH4)2SO4 per gallone di acqua è 378,54 grammi.
D: Si verifica una reazione quando si combinano soluzioni acquose di solfato di ammonio e cloruro di calcio?
R: No, non si verifica alcuna reazione quando si combinano soluzioni acquose di (NH4)2SO4 e cloruro di calcio. I due sali infatti sono solubili in acqua e non formano alcun precipitato insolubile. La soluzione risultante contiene quattro ioni: ammonio (NH4)+, solfato (SO4)2-, calcio (Ca2+) e cloruro (Cl)-.
D: Come precipitare le proteine con solfato di ammonio?
R: Per precipitare le proteine con (NH4)2SO4, è possibile seguire i seguenti passaggi:
- Preparare una soluzione acquosa di (NH4)2SO4 con concentrazione e volume noti.
- Aggiungere la soluzione proteica alla soluzione (NH4)2SO4 lentamente e mescolando.
- Monitorare la torbidità o la densità ottica della miscela per determinare la quantità di precipitazione proteica.
- Centrifugare la miscela per separare il pellet proteico dal surnatante.
- Eliminare il surnatante e lavare il pellet proteico con tampone o acqua per rimuovere il sale in eccesso.
- Risospendere o solubilizzare il pellet proteico in un tampone appropriato per ulteriori analisi o utilizzo.
D: Quanti grammi ci sono in 6,90 molecole di solfato di ammonio?
R: Per scoprire quanti grammi ci sono in 6,90 molecole di (NH4)2SO4, dobbiamo utilizzare il numero di Avogadro e la massa molare di (NH4)2SO4. Il numero di Avogadro è 6,022 x 10^23, il che significa che una mole di qualsiasi sostanza contiene altrettante molecole. La massa molare di (NH4)2SO4 è 132,14 g/mol, il che significa che una mole di (NH4)2SO4 pesa altrettanti grammi. Possiamo quindi usare questa formula per calcolare quanti grammi ci sono in 6,90 molecole di (NH4)2SO4:
grammi = molecole x massa molare / numero di Avogadro grammi = 6,90 x 132,14 / 6,022 x 10^23 grammi = 1,52 x 10^-21 Pertanto, ci sono 1,52 x 10^-21 grammi in 6,90 molecole di (NH4)2SO4.
D: Quanto zolfo c’è nel solfato di ammonio?
R: (NH4)2SO4 contiene il 24% di zolfo in massa. Questo può essere calcolato utilizzando la formula della composizione percentuale e le masse molari di zolfo e (NH4)2SO4. La massa molare dello zolfo è 32,06 g/mol e la massa molare di (NH4)2SO4 è 132,14 g/mol. Pertanto, la percentuale di zolfo in (NH4)2SO4 è:
percentuale = massa molare di zolfo x 100 / massa molare di solfato di ammonio percentuale = 32,06 x 100 / 132,14 percentuale = 24,26%
D: Quale di questi sali è un sale neutro? na2so4 nacn kf(nh4)2so4
R: Un sale neutro è quello che non influenza il pH della soluzione quando disciolto in acqua. Si forma dalla reazione di un acido forte e di una base forte. Dei quattro sali indicati, solo na2so4 è un sale neutro. Si forma dalla reazione tra idrossido di sodio (una base forte) e acido solforico (un acido forte). Altri sali sono acidi o basici. Nacn è un sale basico, formato dalla reazione tra idrossido di sodio (una base forte) e acido cianidrico (un acido debole). Kf è un sale basico, formato dalla reazione tra idrossido di potassio (una base forte) e acido fluoridrico (un acido debole). (Nh4)2so4 è un sale acido, formato dalla reazione tra idrossido di ammonio (una base debole) e acido solforico (un acido forte).
D: Qual è la massa molare di (nh4)2so4?
R: La massa molare di (nh4)2so4 è 132,14 g/mol. Per trovare la massa molare dobbiamo sommare le masse atomiche di tutti gli atomi presenti nella formula. Le masse atomiche sono:
- Azoto: 14,01 g/mol
- Idrogeno: 1,01 g/mol
- Zolfo: 32,06 g/mol
- Ossigeno: 16,00 g/mol
Pertanto, la massa molare di (nh4)2so4 è:
(2 x 14,01) + (8 x 1,01) + 32,06 + (4 x 16,00) = 132,14 g/mol
D: (NH4)2SO4 è solubile in acqua?
R: Sì, (nh4)2so4 è solubile in acqua. Può sciogliere fino a 70,6 grammi per 100 grammi di acqua a 0°C, 74,4 grammi per 100 grammi di acqua a 20°C e 103,8 grammi per 100 grammi di acqua a 100°C.
