Il carbonato di ammonio ((NH4)2CO3) è un sale. Si forma quando reagiscono ammoniaca e anidride carbonica. Ha molti usi, come cuocere al forno e annusare il sale.
| Nome dell’IUPAC | Carbonato di ammonio |
| Formula molecolare | (NH4)2CO3 |
| numero CAS | 506-87-6 |
| Sinonimi | ammoniaca da panettiere, sale volatile, sale di hartshorn, E503 |
| InChI | InChI=1S/CH2O3.2H3N/c2-1(3)4;;/h(H2,2,3,4);2*1H3 |
Proprietà del carbonato di ammonio
Formula di carbonato di ammonio
La formula chimica o formula molecolare del carbonato di ammonio è (NH4)2CO3 1 . È un sale composto da due ioni ammonio e uno ione carbonato. Può essere scritto NH4+ + NH4+ + CO3 2- per mostrare le cariche degli ioni.
Massa molare del carbonato di ammonio
La massa molare di (NH4)2CO3 è 96,09 g/mol 2 . Per calcolare la massa molare, dobbiamo sommare le masse atomiche di tutti gli atomi nella formula. Le masse atomiche sono:
- Azoto: 14,01 g/mol
- Idrogeno: 1,01 g/mol
- Carbonio: 12,01 g/mol
- Ossigeno: 16,00 g/mol
Pertanto, la massa molare del carbonato di ammonio è:
(2 x 14,01) + (8 x 1,01) + 12,01 + (3 x 16,00) = 96,09 g/mol
Punto di ebollizione del carbonato di ammonio
(NH4)2CO3 non ha un punto di ebollizione perché si decompone prima di raggiungere questa temperatura. Quando riscaldato, si decompone in ammoniaca e anidride carbonica, che fuoriesce dal solido. La reazione di decomposizione è:
(NH4)2CO3 -> 2NH3 + CO2 + H2O
La temperatura di decomposizione dipende dall’umidità e dalla pressione dell’ambiente, ma generalmente è intorno ai 60°C.
Carbonato di ammonio Punto di fusione
(NH4)2CO3 ha un punto di fusione di 58°C (136°F; 331 K). Tuttavia a questa temperatura si decompone anche e quindi non forma una fase liquida. Sublima invece direttamente dallo stato solido allo stato gassoso.
Densità del Carbonato di Ammonio g/ml
La densità di (NH4)2CO3 è 1,50 g/ml. La densità è la massa per unità di volume di una sostanza. Per calcolare la densità, dividi la massa per il volume. Ad esempio, se abbiamo 10 g di (NH4)2CO3 e occupano 6,67 ml di spazio, la densità sarà:
10 g/6,67 ml = 1,50 g/ml
Peso molecolare del carbonato di ammonio
Il peso molecolare di (NH4)2CO3 è uguale alla sua massa molare, che è 96,09 g/mol. Il peso molecolare e la massa molare sono spesso usati in modo intercambiabile, ma hanno significati leggermente diversi. Il peso molecolare è la massa di una molecola di una sostanza, mentre la massa molare è la massa di una mole (6,022 x 10^23 molecole) di una sostanza.
Struttura del carbonato di ammonio
La struttura di (NH4)2CO3 può essere rappresentata da una struttura a punti di Lewis o da un modello ball-and-stick. Una struttura a punti di Lewis mostra gli elettroni di valenza di ciascun atomo e il modo in cui vengono condivisi o trasferiti per formare legami. Un modello ball-and-stick mostra la forma e la disposizione degli atomi e dei legami in tre dimensioni.
Ecco una possibile struttura a punti di Lewis per il carbonato di ammonio:
OOOO
|| || ||
HNH HNH HCH
| | |
HHH
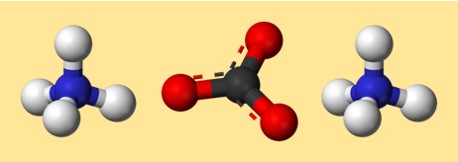
Ecco un possibile modello per il carbonato di ammonio:
In questo modello, ogni colore rappresenta un elemento diverso:
- Grigio: carbonio
- Rosso: ossigeno
- Blu: azoto
- Bianco: idrogeno
Solubilità del carbonato di ammonio
(NH4)2CO3 è solubile in acqua. La solubilità è la capacità di una sostanza di dissolversi in un’altra sostanza. Quando (NH4)2CO3 si dissolve in acqua, forma ioni acquosi che possono interagire con altri ioni o molecole in soluzione. La reazione di dissoluzione è:
(NH4)2CO3 + H2O -> 2 NH4+ + CO3 2- + H2O
La solubilità di (NH4)2CO3 dipende dalla temperatura e dal pH dell’acqua. A temperature più elevate, una maggiore quantità di (NH4)2CO3 può dissolversi nell’acqua.
| Aspetto | polvere bianca |
| Densità specifica | 1,50 |
| Colore | Incolore |
| Odore | Odore pungente di ammoniaca |
| Massa molare | 96,09 g/mole |
| Densità | 1,50 g/ml |
| Punto di fusione | 58°C (136°F; 331K) |
| Punto di ebollizione | Si rompe prima dell’ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | 100 g/100 ml (15°C) |
| Solubilità | Solubile in acqua, alcool e acetone |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | 9,25 (per NH4+) |
| pH | 7,8 (per una soluzione da 0,1 milioni) |
Sicurezza e pericoli del carbonato di ammonio
(NH4)2CO3 è una sostanza pericolosa che può causare irritazione e danni alla pelle, agli occhi, al naso, alla gola e ai polmoni. Potrebbe anche essere dannoso se ingerito. Dovrebbe essere maneggiato con cura e con dispositivi di protezione individuale, come guanti, occhiali e maschere. Dovrebbe essere conservato in un’area fresca, asciutta e ben ventilata, lontano da fonti di calore, scintille e fiamme. Non deve essere miscelato con acidi forti, basi o agenti riducenti poiché potrebbe reagire violentemente o rilasciare gas tossici. In caso di esposizione, consultare immediatamente un medico.
| Simboli di pericolo | Xi (irritante) |
| Descrizione della sicurezza | S22: Non respirare le polveri. S24/25: Evitare il contatto con la pelle e gli occhi. |
| Numeri di identificazione delle Nazioni Unite | UN3077 |
| Codice SA | 28369910 |
| Classe di pericolo | 9 |
| Gruppo di imballaggio | III |
| Tossicità | LD50 orale ratto: 2000 mg/kg |
Metodi di sintesi del carbonato di ammonio
Diversi metodi possono sintetizzare (NH4)2CO3, a seconda dei materiali con cui iniziano e della purezza desiderata del prodotto. Ecco alcuni esempi di metodi per sintetizzare (NH4)2CO3:
- Un metodo prevede la reazione del solfato di ammonio con cloruro di ammonio e carbonato di calcio in un forno. La reazione produce (NH4)2CO3 e cloruro di calcio come sottoprodotti. La reazione è:
(NH4)2SO4 + 2 NH4Cl + CaCO3 -> 2 (NH4)2CO3 + CaCl2
- Un altro metodo prevede la reazione con anidride carbonica e ammoniaca in una soluzione acquosa. La reazione produce (NH4)2CO3 e acqua come sottoprodotti. La reazione è:
CO2 + 2 NH3 + H2O -> (NH4)2CO3 + H2O
- Un terzo metodo prevede l’esposizione di una soluzione di ammonio all’aria contenente anidride carbonica. Il bicarbonato di ammonio è il prodotto della reazione e il riscaldamento può scomporlo ulteriormente in (NH4)2CO3.
Le reazioni sono:
NH3+CO2+H2O -> NH4HCO3
NH4HCO3 -> NH3 + CO2 + H2O
(NH4)2CO3 -> (NH4)2CO3
- L’esposizione del bicarbonato di ammonio all’aria produce (NH4)2CO3 per uso commerciale. Il bicarbonato di ammonio si scompone in ammoniaca e anidride carbonica, che reagiscono nuovamente per formare (NH4)2CO3. Il processo è:
NH4HCO3 -> NH3 + CO2
NH3 + CO2 -> (NH4)2CO3
Usi del carbonato di ammonio
(NH4)2CO3 ha molteplici utilizzi in diversi ambiti, quali:
- I fornai lo usano come agente lievitante, soprattutto per biscotti e cracker piatti o croccanti. Produce anidride carbonica e gas di ammoniaca che aiutano l’impasto a lievitare e creare una consistenza leggera. Inoltre esalta il sapore e l’aroma dei prodotti da forno.
- Le persone lo usano come sale profumato per rianimare le persone che sono svenute o che si sentono infelici. Stimola il sistema respiratorio e aumenta la pressione sanguigna rilasciando vapori di ammoniaca che irritano naso e polmoni.
- Alcuni sciroppi per la tosse ed espettoranti, come lo sciroppo per la tosse di Buckley, lo utilizzano come ingrediente attivo. Aiuta a sciogliere ed espellere il catarro dal petto e dalla gola aumentando la secrezione di muco.
- I medici lo usano come emetico per indurre il vomito in caso di avvelenamento o sovradosaggio. Irrita il rivestimento dello stomaco e provoca nausea e vomito rilasciando anidride carbonica.
- I chimici lo usano come reagente in alcune reazioni chimiche, come la sintesi di urea, nitrato di ammonio e solfato di ammonio. Agisce anche come tampone per mantenere il pH delle soluzioni.
Domande:
D: Il carbonato di ammonio è acido o basico?
R: (NH4)2CO3 è un sale che può reagire sia con acidi che con basi. Quando si dissolve in acqua, forma ioni ammonio e ioni carbonato. Gli ioni di ammonio possono agire come acidi deboli e donare protoni all’acqua, mentre gli ioni carbonato possono agire come basi deboli e accettare protoni dall’acqua. Il pH della soluzione dipende dalla forza relativa degli ioni ammonio e degli ioni carbonato. Se gli ioni carbonato sono basi più forti di quanto gli ioni ammonio siano acidi, la soluzione sarà basica. La soluzione sarà acida se gli ioni ammonio sono acidi più forti di quanto gli ioni carbonato siano basi. Se gli ioni ammonio e gli ioni carbonato hanno forza simile, la soluzione sarà neutra.
D: Il carbonato di ammonio è un sale?
R: Sì, (NH4)2CO3 è un sale. Un sale è un composto che si forma quando un acido e una base si neutralizzano a vicenda. (NH4)2CO3 si può formare quando l’ammoniaca, una base debole, reagisce con l’acido carbonico, un acido debole. La reazione è:
2NH3 + H2CO3 -> (NH4)2CO3 + H2O
L’ammoniaca e l’acido carbonico sono la base madre e l’acido di (NH4)2CO3.
D: Il carbonato di ammonio (aq) ha un odore in forma acquosa?
R: Sì, (NH4)2CO3 (aq) ha un odore in forma acquosa. L’odore è dovuto al rilascio di gas di ammoniaca dalla soluzione. Il gas di ammoniaca ha un odore pungente che può irritare il naso e i polmoni. Il gas di ammoniaca può fuoriuscire dalla soluzione perché è volatile e ha una bassa solubilità in acqua. La quantità di gas di ammoniaca rilasciata dipende dalla temperatura e dalla concentrazione della soluzione.
D: Che tipo di atomo è il carbonato di ammonio?
R: (NH4)2CO3 non è un atomo, ma una molecola. Una molecola è un gruppo di atomi legati tra loro dalla condivisione di elettroni. Un atomo è la più piccola unità di materia con un’identità chimica definita. (NH4)2CO3 è una molecola composta da quattro diversi tipi di atomi: azoto, idrogeno, carbonio e ossigeno. La formula molecolare di (NH4)2CO3 è (NH4)2CO3.
D: Quante moli ci sono nel carbonato di ammonio?
R: Per rispondere a questa domanda, dobbiamo sapere quanto (NH4)2CO3 abbiamo in termini di massa o volume. Una mole è un’unità di misura che rappresenta 6.022 x 10^23 particelle di una sostanza. Il numero di moli di una sostanza può essere calcolato dividendo la sua massa per la sua massa molare o moltiplicando il suo volume per la sua molarità. La massa molare di (NH4)2CO3 è 96,09 g/mol. La molarità di (NH4)2CO3 dipende dalla sua dissoluzione in acqua.
Ad esempio, se abbiamo 10 g di (NH4)2CO3, possiamo trovare il numero di moli dividendo 10 g per 96,09 g/mol:
10 g / 96,09 g/mol = 0,104 moli
Se abbiamo 100 ml di soluzione 0,1 M (NH4)2CO3, possiamo trovare il numero di moli moltiplicando 100 ml per 0,1 mol/L:
100 ml x 0,1 mole/L = 0,01 mole
D: Qual è la formula chimica del carbonato di ammonio?
R: La formula chimica del carbonato di ammonio è (NH4)2CO3. Questa formula mostra che una molecola di (NH4)2CO3 contiene due ioni ammonio (NH4+) e uno ione carbonato (CO3 2-). Le cariche sugli ioni si bilanciano, quindi la carica complessiva sulla molecola è zero.
D: Quante moli di ioni ammonio ci sono in 6,995 g di carbonato di ammonio?
R: Per rispondere a questa domanda, dobbiamo seguire due passaggi:
- Per prima cosa dobbiamo determinare quante moli di (NH4)2CO3 ci sono in 6,995 g dividendo 6,995 g per la sua massa molare (96,09 g/mol):
6,995 g / 96,09 g/mol = 0,0728 moli
- In secondo luogo, dobbiamo moltiplicare questo numero per due, perché ogni mole di (NH4)2CO3 contiene due moli di ioni ammonio:
0,0728 moli x 2 = 0,1456 moli
In 6,995 g di (NH4)2CO3 ci sono quindi 0,1456 moli di ioni ammonio.
D: Quale gas viene prodotto quando l’acido cloridrico reagisce con il carbonato di ammonio?
R: Quando l’acido cloridrico reagisce con (NH4)2CO3, subisce una doppia reazione di spostamento per produrre cloruro di ammonio e acido carbonico. L’acido carbonico poi si scompone in acqua e anidride carbonica. L’anidride carbonica è il gas prodotto da questa reazione. L’equazione generale per questa reazione è la seguente:
(NH4)2CO3 + 2 HCl -> 2 NH4Cl + H2CO3
H2CO3 -> H2O + CO2
L’equazione ionica netta per questa reazione è:
CO3 2- + 2 H+ -> H2O + CO2
