Il perclorato di calcio (Ca(ClO4)2) è un composto chimico che ha molti usi, inclusi fuochi d’artificio e propellenti per razzi. È molto solubile in acqua e può essere utilizzato anche come agente essiccante.
| Nome IUPAC | Perclorato di calcio |
| Formula molecolare | Ca(ClO4)2 |
| numero CAS | 13477-36-6 |
| Sinonimi | Calciofos, sale di calcio dell’acido perclorico, diperclorato di calcio, perclorato di calcio (II), UN1459 |
| InChI | InChI=1S/Ca.2ClHO4/c;2 2-1(3,4)5/h;2 (H,2,3,4,5)/q+2;;/p-2 |
Proprietà del perclorato di calcio
Formula di perclorato di calcio
La formula del perclorato di calcio è Ca(ClO4)2. È composto da uno ione Ca2+ e due ioni ClO4-. Lo ione calcio ha una carica positiva di 2+ e ciascuno ione ClO4- ha una carica negativa di 1-. Questa formula viene utilizzata per rappresentare la struttura chimica del perclorato di calcio.
Massa molare del perclorato di calcio
La massa molare di Ca(ClO4)2 è 238,98 g/mol. Questo valore rappresenta la massa di una mole di Ca(ClO4)2, che contiene il numero di molecole di Avogadro. La massa molare è importante per determinare la quantità di Ca(ClO4)2 necessaria in una particolare reazione.
Punto di ebollizione del perclorato di calcio
Ca(ClO4)2 non ha un punto di ebollizione perché si decompone prima di raggiungere il punto di ebollizione. Quando riscaldato, si decompone in cloruro di calcio, ossigeno gassoso e cloro gassoso. Questa reazione di decomposizione è fortemente esotermica e rilascia una quantità significativa di calore.
Perclorato di calcio Punto di fusione
Il punto di fusione di Ca(ClO4)2 è 200°C. Questa temperatura è il punto in cui il Ca(ClO4)2 solido si trasforma in uno stato liquido. Il punto di fusione è importante nel determinare le proprietà fisiche del Ca(ClO4)2, come la sua capacità di essere utilizzato come agente essiccante.
Densità del perclorato di calcio g/mL
La densità di Ca(ClO4)2 è 2,505 g/mL. Questo valore rappresenta la quantità di massa per unità di volume di Ca(ClO4)2. La densità di Ca(ClO4)2 è maggiore di quella dell’acqua, il che significa che affonda nell’acqua.
Peso molecolare del perclorato di calcio
Il peso molecolare di Ca(ClO4)2 è 238,98 g/mol. Questo valore rappresenta la somma dei pesi atomici di tutti gli atomi in una molecola di Ca(ClO4)2. Il peso molecolare è importante per determinare la quantità di Ca(ClO4)2 necessaria in una particolare reazione.
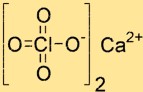
Struttura del perclorato di calcio
La struttura di Ca(ClO4)2 è composta da uno ione Ca2+ e due ioni ClO4-. Lo ione Ca2+ si trova al centro della struttura ed è circondato da quattro atomi di ossigeno originati da due ioni ClO4-. Gli ioni ClO4- hanno forma tetraedrica e sono collegati allo ione calcio tramite atomi di ossigeno.
Solubilità del perclorato di calcio
Ca(ClO4)2 è altamente solubile in acqua, con una solubilità di 121 g/100 mL a 20°C. Questa solubilità lo rende utile come agente essiccante perché può assorbire l’acqua dall’ambiente circostante. Tuttavia, è insolubile in solventi organici come etanolo e acetone.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 2.505 g/ml |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 238,98 g/mole |
| Densità | 2.505 g/ml |
| Punto di fusione | 200°C |
| Punto di ebollizione | Si decompone prima del punto di ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | 121 g/100 ml a 20°C |
| Solubilità | Insolubile nei solventi organici |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | Non disponibile |
| pH | Non applicabile |
Sicurezza e pericoli del perclorato di calcio
Il Ca(ClO4)2 comporta diversi rischi per la sicurezza e durante la sua manipolazione è necessario adottare misure di sicurezza adeguate. È un forte ossidante che può reagire con materiali infiammabili, provocando un incendio o un’esplosione. L’inalazione delle sue polveri o vapori può causare irritazione delle vie respiratorie e il contatto con la pelle può causare irritazioni o ustioni. È nocivo anche se ingerito, provocando irritazione o corrosione del tratto digestivo. Quando si maneggia Ca(ClO4)2 è necessario indossare adeguati dispositivi di protezione individuale, come guanti e occhiali protettivi, e conservarli lontano da materiali infiammabili e sostanze incompatibili.
| Simboli di pericolo | Agente ossidante, nocivo per ingestione |
| Descrizione della sicurezza | Tenere lontano da materiali infiammabili e sostanze incompatibili. Indossare guanti e occhiali protettivi. Evitare l’inalazione di polvere o fumi. In caso di contatto lavare abbondantemente con acqua ed eventualmente consultare un medico. |
| Numeri di identificazione delle Nazioni Unite | UN1502 |
| Codice SA | 2829.9000 |
| Classe di pericolo | 5.1 – Sostanze ossidanti |
| Gruppo di imballaggio | II |
| Tossicità | Nocivo per ingestione, irritante per la pelle e le vie respiratorie |
Metodi per la sintesi del perclorato di calcio
Ca(ClO4)2 può essere sintetizzato facendo reagire l’idrossido di calcio con acido perclorico o perclorato di ammonio.
Un metodo prevede la reazione del carbonato di calcio con l’acido perclorico in un recipiente di reazione, seguita dalla filtrazione e dall’evaporazione della soluzione per ottenere il prodotto solido.
Un altro metodo prevede la reazione dell’ossido di calcio con una soluzione acquosa di acido perclorico, seguita dalla filtrazione e dall’essiccazione del prodotto risultante.
In alcuni casi, Ca(ClO4)2 può essere sintetizzato facendo reagire il cloruro di calcio con il perclorato di sodio in un recipiente di reazione. Il prodotto può essere filtrato ed essiccato per ottenere Ca(ClO4)2 dopo la reazione.
Un altro metodo popolare per sintetizzare Ca(ClO4)2 prevede la reazione del cloruro di calcio con il perclorato di ammonio, che produce Ca(ClO4)2 e cloruro di ammonio come sottoprodotti. Le applicazioni pirotecniche preferiscono questo metodo per la sua capacità di produrre Ca(ClO4)2 di elevata purezza.
È importante notare che quando si lavora con l’acido perclorico è necessario adottare adeguate precauzioni di sicurezza, poiché si tratta di un forte agente ossidante che può reagire con materiali organici, provocando un incendio o un’esplosione.
Usi del perclorato di calcio
Ca(ClO4)2 ha diversi usi in vari settori e applicazioni. Alcuni degli usi di Ca(ClO4)2 sono:
- Pirotecnica: comunemente usato in pirotecnica come agente ossidante grazie al suo elevato contenuto di ossigeno e stabilità.
- Fertilizzante: utilizzato nei fertilizzanti per fornire alle piante calcio e cloro, nutrienti essenziali per la loro crescita.
- Carburante per razzi: utilizzato come componente del carburante per razzi grazie al suo elevato contenuto di ossigeno e alla sua stabilità.
- Raffinazione del petrolio: utilizzato nell’industria petrolifera per rimuovere i composti di zolfo dal petrolio greggio e da altri idrocarburi.
- Dispositivi di gonfiaggio per airbag: utilizzati nella produzione di dispositivi di gonfiaggio per airbag grazie alla loro capacità di rompersi rapidamente e generare gas.
- Torce: utilizzate nella produzione di torce a causa del loro elevato contenuto di ossigeno e stabilità.
- Trattamento superficiale dei metalli: utilizzato nel trattamento delle superfici metalliche per rimuovere ruggine e altre impurità.
- Applicazioni di laboratorio: utilizzato in varie applicazioni di laboratorio, come nella preparazione dell’acido perclorico e come agente essiccante.
Domande:
D: Qual è la formula del perclorato di calcio?
R: Ca(ClO4)2.
D: Il perclorato di calcio è ionico o covalente?
R: Ca(ClO4)2 è un composto ionico perché è composto da cationi calcio (Ca2+) e anioni perclorato (ClO4-).
D: Come posso smaltire il perclorato di calcio?
R: Ca(ClO4)2 può essere rimosso lavando la zona interessata con acqua, quindi neutralizzando eventuali tracce rimanenti del composto con una base debole, come il bicarbonato di sodio.
D: Il perclorato di calcio è solubile?
R: Sì, Ca(ClO4)2 è solubile in acqua e altri solventi polari. La sua solubilità in acqua è di circa 120 g per 100 ml di acqua a temperatura ambiente.
D: Quali reazioni producono il perclorato di calcio e l’acqua?
R: Ca(ClO4)2 e l’acqua non reagiscono tra loro in condizioni normali.
D: Quanti atomi di cloro ci sono in 0,650 moli di Ca(ClO4)2?
R: Ci sono 5,88 x 10^23 atomi di cloro in 0,650 moli di Ca(ClO4)2.
D: Qual è la massa molare di Ca(ClO4)2?
R: La massa molare di Ca(ClO4)2 è 238,98 g/mol.
D: Qual è il coefficiente di attività di H in una soluzione contenente HCl 0,073 M e Ca(ClO4)2 0,0090 M?
R: Il coefficiente di attività di H in una soluzione contenente HCl 0,073 M e Ca(ClO4)2 0,0090 M dipende dalla temperatura e da altri fattori. Può essere calcolato utilizzando modelli termodinamici e dati sperimentali.
D: Quante moli ci sono in 26,0 grammi di Ca(ClO4)2?
R: Ci sono 0,109 moli di Ca(ClO4)2 in 26,0 grammi di composto.
