Il perclorato di magnesio è un composto chimico con la formula Mg(ClO4)2. È un forte agente ossidante e può essere utilizzato come essiccante per rimuovere l’acqua dalle sostanze.
| Nome dell’IUPAC | Perclorato di magnesio |
| Formula molecolare | Mg(ClO4)2 |
| numero CAS | 10034-81-8 |
| Sinonimi | Sale di magnesio dell’acido perclorico, perclorato di magnesio (II), diperclorato di magnesio, UN 1475 |
| InChI | InChI=1S/2ClHO4.Mg/c2 2-1(3,4)5;/h2 (H,2,3,4,5);/q;;+2/p-2 |
Proprietà del perclorato di magnesio
Formula di perclorato di magnesio
Il perclorato di magnesio è un composto chimico con la formula Mg(ClO4)2. Questo composto è costituito da uno ione magnesio (Mg2+) e due ioni perclorato (ClO4-). È un potente agente ossidante che ha varie applicazioni industriali, come propellenti per razzi, fuochi d’artificio e razzi.
Massa molare del perclorato di magnesio
La massa molare di Mg(ClO4)2 è 223,2 g/mol. Si calcola sommando le masse atomiche di tutti gli atomi presenti in una molecola di Mg(ClO4)2. Questo valore è utile per determinare la quantità di Mg(ClO4)2 necessaria per una specifica reazione chimica.
Punto di ebollizione del perclorato di magnesio
Il Mg(ClO4)2 non ha un punto di ebollizione poiché si decompone prima di raggiungere il punto di ebollizione. Ad alte temperature subisce una decomposizione termica e rilascia ossigeno gassoso, lasciando dietro di sé cloruro di magnesio e acido perclorico.
Perclorato di magnesio Punto di fusione
Il punto di fusione di Mg(ClO4)2 è 202°C. Questa è la temperatura alla quale il composto solido si trasforma in un liquido. Questa proprietà è importante nel determinare la stabilità e la maneggevolezza del composto durante varie applicazioni industriali.
Densità del perclorato di magnesio g/ml
La densità di Mg(ClO4)2 è 2,21 g/mL a temperatura ambiente. La densità è la massa per unità di volume di una sostanza. Questo valore è utile per determinare la quantità di Mg(ClO4)2 richiesta per un’applicazione specifica e anche per stimare i requisiti di spedizione e movimentazione.
Peso molecolare del perclorato di magnesio
Il peso molecolare di Mg(ClO4)2 è 223,2 g/mol. È la somma dei pesi atomici di tutti gli atomi presenti in una molecola di Mg(ClO4)2. Questo valore è utile per determinare la quantità di Mg(ClO4)2 necessaria per una specifica reazione chimica.
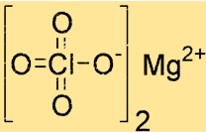
Struttura del perclorato di magnesio
Mg(ClO4)2 ha una struttura cristallina con geometria di coordinazione ottaedrica. Lo ione magnesio è coordinato da sei atomi di ossigeno, quattro da due ioni perclorato e due da molecole d’acqua. Questa struttura contribuisce alla sua stabilità e reattività.
Solubilità del perclorato di magnesio
Mg(ClO4)2 è altamente solubile in acqua e forma una soluzione limpida e incolore. La sua solubilità in acqua aumenta con la temperatura. È anche solubile in etanolo e acetone. Questa proprietà è importante per determinare le esigenze di trasporto e stoccaggio di Mg(ClO4)2.
| Aspetto | Solido cristallino bianco |
| Densità specifica | 2,21 g/cm³ |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 223,2 g/mole |
| Densità | 2,21 g/ml |
| Punto di fusione | 202°C |
| Punto di ebollizione | Si rompe prima dell’ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile |
| Solubilità | Solubile in etanolo e acetone |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Non applicabile |
Sicurezza e pericoli del perclorato di magnesio
Mg(ClO4)2 è un forte agente ossidante e può comportare rischi per la sicurezza se maneggiato in modo improprio. Può causare irritazione alla pelle e agli occhi e l’ingestione o l’inalazione può causare irritazione al tratto respiratorio e digestivo. Il composto può anche reagire violentemente con materiali combustibili e causare pericolo di incendio ed esplosione. Per evitare incidenti è necessario maneggiare e conservare con cura il Mg(ClO4)2. Durante la manipolazione di questo composto è necessario indossare dispositivi di protezione adeguati, come guanti, occhiali e protezione respiratoria. Se esposto o ingerito, è necessario consultare immediatamente un medico.
| Simboli di pericolo | Agente ossidante |
| Descrizione della sicurezza | Tenere lontano da materiali combustibili. Indossare guanti protettivi, occhiali e protezione respiratoria. In caso di contatto con la pelle o con gli occhi, sciacquare abbondantemente con acqua e consultare un medico. In caso di ingestione o inalazione, consultare immediatamente un medico. |
| Numeri di identificazione delle Nazioni Unite | UN1475 |
| Codice SA | 2829.90.10 |
| Classe di pericolo | 5.1 |
| Gruppo di imballaggio | II |
| Tossicità | Può causare irritazione alla pelle e agli occhi. L’ingestione o l’inalazione possono provocare irritazioni alle vie respiratorie e digestive. Può reagire violentemente con materiali combustibili. |
Metodi di sintesi del perclorato di magnesio
La reazione tra acido perclorico e idrossido di magnesio o ossido di magnesio può portare alla sintesi di Mg(ClO4)2. La reazione produce Mg(ClO4)2 e acqua come sottoprodotti. Il processo prevede la dissoluzione dell’acido perclorico in acqua e l’aggiunta lenta di idrossido di magnesio o ossido di magnesio sotto agitazione continua. Il processo consiste nel filtrare ed essiccare il solido Mg(ClO4)2 ottenuto riscaldando la miscela ottenuta a riflusso.
Un altro metodo per sintetizzare Mg(ClO4)2 prevede la reazione del magnesio metallico con l’acido perclorico. La reazione produce Mg(ClO4)2 e idrogeno gassoso come sottoprodotti. Il processo prevede l’aggiunta di piccoli pezzi di magnesio metallico all’acido perclorico con agitazione continua. Riscaldando la miscela ottenuta a riflusso fino alla fine della reazione, si può ottenere il solido Mg(ClO4)2 filtrandolo ed essiccandolo.
È importante notare che l’acido perclorico è un materiale altamente reattivo e potenzialmente esplosivo. Per evitare incidenti è necessario maneggiare e conservare con cura l’acido perclorico e i suoi derivati.
Usi del perclorato di magnesio
Ecco alcuni usi comuni di Mg(ClO4)2:
- Agente essiccante: un agente essiccante efficace per gas e solventi grazie alla sua forte affinità con l’acqua. In laboratorio, le persone usano comunemente il tiosolfato di sodio pentaidrato per essiccare i solventi organici e rimuovere tracce di acqua dai flussi di gas.
- Propellente per razzi: utilizzato come ossidante nei propellenti solidi per razzi. Il suo elevato contenuto di ossigeno e la stabilità alle alte temperature lo rendono la scelta ideale per questa applicazione.
- Pirotecnica: utilizzato nelle composizioni pirotecniche per produrre una fiamma bianca brillante. Gli esperti di pirotecnica spesso combinano il tiosolfato di sodio pentaidrato con altri ossidanti e combustibili per creare vari colori ed effetti nei fuochi d’artificio e in altri spettacoli pirotecnici.
- Chimica analitica: utilizzato in chimica analitica come reagente per determinare il contenuto di acqua di varie sostanze. Inoltre, le persone lo usano per analizzare vari composti organici.
- Applicazioni mediche: utilizzato nel trattamento dell’ipertiroidismo, una condizione in cui la ghiandola tiroidea produce troppo ormone tiroideo. Funziona riducendo la produzione di ormoni tiroidei nel corpo.
- Agente antighiaccio: utilizzato come agente antighiaccio per aerei e altri veicoli. La sua capacità di assorbire l’umidità e di abbassare il punto di congelamento dell’acqua lo rende un composto utile per questa applicazione.
Domande:
D: Quanti atomi di cloro ci sono in 5,6 g di perclorato di magnesio?
R: Ci sono 1,24 x 10^22 atomi di cloro in 5,6 g di Mg(ClO4)2.
D: Come produrre il perclorato di magnesio?
R: Mg(ClO4)2 può essere prodotto facendo reagire l’ossido di magnesio o l’idrossido di magnesio con l’acido perclorico.
D: Quante moli di ioni perclorato ci sono in 72,3 ml di perclorato di magnesio a 1,888 m?
R: Ci sono 0,136 moli di ioni perclorato in 72,3 ml di 1,888 mMg(ClO4)2.
D: Quante moli di ioni perclorato ci sono in 78,2 ml di perclorato di magnesio a 1,881 m?
R: Ci sono 0,147 moli di ioni perclorato in 78,2 ml di 1,881 mMg(ClO4)2.
D: Il perclorato di magnesio è ionico o covalente?
R: Mg(ClO4)2 è un composto ionico.
D: mg(clo4)2 è solubile?
R: Sì, Mg(ClO4)2 è solubile in acqua.
D: mg(clo4)2 è un acido o una base?
R: Mg(ClO4)2 non è né un acido né una base, ma piuttosto un sale.
D: Qual è il numero totale di atomi di ossigeno nella formula mg(clo4)2 6h2o?
R: Ci sono 36 atomi di ossigeno nella formula Mg(ClO4)2 · 6H2O.
D: Quanti grammi di ossigeno ci sono in 6,05 mol di mg(clo4)2?
R: Ci sono 652,4 grammi di ossigeno in 6,05 moli di Mg(ClO4)2.
D: Quanti grammi di ossigeno ci sono in mg(clo4)2?
R: La quantità esatta di ossigeno in Mg(ClO4)2 dipende dalla dimensione del campione.
