L’1-butanolo (C4H9OH) è un alcol incolore con un odore leggermente dolce. È utilizzato come solvente, nella sintesi organica e come fonte di combustibile. Può essere utilizzato anche in prodotti cosmetici e per la cura personale.
| Nome IUPAC | Butan-1-olo |
| Formula molecolare | C4H10O |
| numero CAS | 71-36-3 |
| Sinonimi | alcol n-butilico, butanolo, alcol butilico, alcol 1-butilico, 1-butanolo, butanolene, butilene idrato, butile idrato |
| InChI | InChI=1S/C4H10O/c1-2-3-4-5/h5H,2-4H2,1H3 |
Proprietà dell’1-butanolo
Formula 1-butanolo
La formula molecolare dell’1-butanolo è C4H10O. Ciò significa che contiene quattro atomi di carbonio, dieci atomi di idrogeno e un atomo di ossigeno. Ha una struttura lineare, con il gruppo ossidrile (-OH) attaccato al primo atomo di carbonio.
Massa molare di 1-butanolo
La massa molare di C4H9OH è 74,12 g/mol. Ciò significa che una mole di C4H9OH pesa 74,12 grammi. La massa molare è una proprietà importante di una sostanza perché aiuta a determinare la quantità di sostanza presente in un dato campione.
Punto di ebollizione dell’1-butanolo
C4H9OH ha un punto di ebollizione di 117,7°C (243,9°F). Ciò significa che cambierà da liquido a gas a questa temperatura. Il punto di ebollizione di C4H9OH è superiore a quello dell’etanolo a causa della presenza di un atomo di carbonio in più.
Punto di fusione del 1-butanolo
Il punto di fusione di C4H9OH è -90,6°C (-131,1°F). Ciò significa che cambierà da solido a liquido a questa temperatura. Il punto di fusione di C4H9OH è inferiore a quello dell’acido butanoico, che ha un peso molecolare simile.
1-Butanolo Densità g/ml
La densità di C4H9OH è 0,81 g/mL. Ciò significa che un millilitro di C4H9OH pesa 0,81 grammi. La densità di C4H9OH è inferiore a quella dell’acqua, che ha una densità di 1 g/mL.
Peso molecolare dell’1-butanolo
Il peso molecolare di C4H9OH è 74,12 g/mol. È la somma dei pesi atomici di tutti gli atomi nella sua formula molecolare. Il peso molecolare è una proprietà importante di una sostanza perché aiuta a determinarne le proprietà fisiche e chimiche.
Struttura dell’1-butanolo
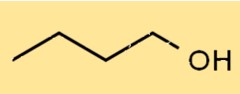
La struttura di C4H9OH è un alcol a catena lineare, con il gruppo ossidrile (-OH) attaccato al primo atomo di carbonio. Ha una struttura lineare, con quattro atomi di carbonio, dieci atomi di idrogeno e un atomo di ossigeno. La sua struttura gli consente di formare legami idrogeno con altre molecole.
Solubilità dell’1-butanolo
C4H9OH è solubile in acqua e solventi organici. La sua solubilità in acqua diminuisce all’aumentare della temperatura. È anche solubile in solventi polari, come etanolo e metanolo. La solubilità di C4H9OH nei solventi organici, come benzene ed etere, è maggiore che in acqua. Ciò lo rende utile come solvente nella sintesi organica.
| Aspetto | Liquido incolore |
| Peso specifico | 0,810 g/ml a 25°C |
| Colore | Incolore |
| Odore | Leggermente dolce |
| Massa molare | 74,12 g/mole |
| Densità | 0,81 g/ml |
| Punto di fusione | -90,6°C (-131,1°F) |
| Punto di ebollizione | 117,7°C (243,9°F) |
| Punto flash | 35°C (95°F) |
| solubilità in acqua | 79 g/l a 20°C |
| Solubilità | Solubile in etanolo, etere etilico, acetone, benzene, cloroformio |
| Pressione del vapore | 1,16 kPa a 20°C |
| Densità del vapore | 2,55 (rispetto all’aria) |
| pKa | 16.06 |
| pH | Neutro (7) |
1-Sicurezza e pericoli del butanolo
C4H9OH presenta diversi rischi per la sicurezza, rendendo fondamentale maneggiarlo con attenzione. È un liquido infiammabile che può facilmente accendersi se esposto a calore o scintille. Inoltre emette vapori nocivi che possono causare irritazioni e danni agli occhi, al sistema respiratorio e alla pelle. Se ingerito, può causare seri problemi di salute, tra cui vertigini, confusione e persino coma. È quindi essenziale indossare dispositivi di protezione come guanti, occhiali e respiratori durante la manipolazione di C4H9OH. In caso di contatto con la pelle o con gli occhi, sciacquare con acqua e consultare immediatamente un medico. Lo stoccaggio, la manipolazione e lo smaltimento adeguati di C4H9OH sono necessari per prevenire incidenti e garantire la sicurezza.
| Simboli di pericolo | F, Xi |
| Descrizione della sicurezza | Tenere lontano da fonti di calore/scintille/fiamme libere/superfici calde. Indossare guanti protettivi/proteggere gli occhi/il viso. IN CASO DI CONTATTO CON LA PELLE (o con i capelli): rimuovere immediatamente tutti gli indumenti contaminati. Sciacquare la pelle con acqua/fare una doccia. IN CASO DI CONTATTO CON GLI OCCHI: sciacquare accuratamente con acqua per diversi minuti. Rimuovere le lenti a contatto, se presenti ed è facile da fare. Continua a risciacquare. Conservare in un’area fresca, asciutta e ben ventilata, lontano da sostanze incompatibili. |
| Numeri di identificazione delle Nazioni Unite | ONU 1120 |
| Codice SA | 2905.16.00 |
| Classe di pericolo | 3 |
| Gruppo di imballaggio | III |
| Tossicità | LD50 (orale, ratto) 2,46 g/kg; LC50 (inalazione, ratto) 37.800 ppm/4 ore |
Metodi per la sintesi dell’1-butanolo
C4H9OH può essere sintetizzato con diversi metodi, tra cui la riduzione della butirraldeide, la lavorazione con osso o la fermentazione.
La fermentazione è un metodo comune per produrre C4H9OH dalla biomassa. Nel processo di fermentazione, microrganismi come Clostridium acetobutylicum sono responsabili della produzione di una miscela di acidi organici e alcoli, incluso C4H9OH, facendo fermentare zuccheri, amidi o cellulosa.
Il processo oxo, noto anche come idroformilazione, prevede la reazione del propene con monossido di carbonio e idrogeno in presenza di un catalizzatore come cobalto o rodio. L’idrogenazione della butirraldeide produce C4H9OH. Quando la butirraldeide subisce idrogenazione, forma il composto C4H9OH.
Un altro metodo per sintetizzare C4H9OH prevede la riduzione della butirraldeide con idrogeno in presenza di un catalizzatore come palladio o nichel. Questa reazione produce C4H9OH con acqua come sottoprodotto.
Il processo Fischer-Tropsch è un metodo per produrre C4H9OH da combustibili fossili. Ciò comporta l’uso di un catalizzatore per far reagire monossido di carbonio e idrogeno, con conseguente produzione di vari idrocarburi, incluso C4H9OH.
Usi dell’1-butanolo
C4H9OH ha molti usi in vari settori grazie alle sue proprietà uniche. Alcuni usi comuni di C4H9OH includono:
- Solvente: Utilizzato come solvente per varie sostanze, tra cui resine, grassi, oli e cere.
- Intermedio: utilizzato come intermedio nella produzione di altri prodotti chimici, come acrilato di butile e acetato di butile.
- Additivo: utilizzato come additivo nella benzina e nei carburanti diesel per aumentarne il numero di ottano e ridurre le emissioni.
- Estraente: utilizzato come estraente nella produzione di antibiotici, vitamine e ormoni.
- Prodotti cosmetici e per la cura personale: utilizzati nella produzione di vari prodotti cosmetici e per la cura personale, tra cui lozioni, creme e profumi.
- Aromi e fragranze: utilizzati come esaltatori di sapore e fragranza nell’industria alimentare e delle bevande.
- Prodotti farmaceutici: utilizzati nella produzione di vari prodotti farmaceutici, inclusi sedativi e ipnotici.
- Pesticidi: Utilizzato come componente nella produzione di vari pesticidi ed erbicidi.
Domande:
D: Il butanolo è polare?
R: Sì, il butanolo è polare a causa della presenza del gruppo ossidrile (-OH) che gli conferisce un momento dipolare.
D: L’1-butanolo è solubile in acqua?
R: Sì, C4H9OH è parzialmente solubile in acqua a causa della presenza del gruppo ossidrile che gli consente di formare legami idrogeno con le molecole d’acqua.
D: L’1-butanolo ha un legame idrogeno?
R: Sì, C4H9OH ha un legame idrogeno dovuto alla presenza del gruppo ossidrile (-OH) che può formare legami idrogeno con altre molecole C4H9OH o con molecole d’acqua.
D: Quanti ml di 1-butanolo sono necessari per preparare 725 ml di una soluzione acquosa 0,350 m di questo soluto?
R: Il calcolo richiede la massa molare di C4H9OH, che è 74,12 g/mol. Per preparare una soluzione 0,350 M di C4H9OH sono necessari 26,12 g di C4H9OH. Utilizzando la formula: moli = concentrazione x volume, possiamo calcolare il volume di C4H9OH necessario come segue: volume = moli / concentrazione. Pertanto, il volume di C4H9OH necessario per preparare 725 ml di una soluzione da 0,350 m è (26,12/0,350) = 74,6 ml.
D: Quale alcol si comporterà più come l’acqua? c2h5oh c4h9oh c10h21oh c7h15oh
R: Tra le opzioni fornite, l’etanolo (C2H5OH) si comporterà più come l’acqua a causa delle sue piccole dimensioni molecolari e della presenza del gruppo ossidrile (-OH), che gli consente di formare forti legami idrogeno con le molecole d’acqua.
D: Quali sono i prodotti dell’equazione bilanciata per la combustione di c4h9oh?
R: L’equazione bilanciata per la combustione di C4H9OH è: C4H9OH + 6O2 → 4CO2 + 5H2O. I prodotti della reazione sono anidride carbonica (CO2) e acqua (H2O).
D: Qual è la massa molare del butanolo (c4h9oh)?
R: La massa molare del butanolo (C4H9OH) è 74,12 g/mol.
D: C4h9oh ha un legame idrogeno?
R: Sì, C4H9OH ha un legame idrogeno dovuto alla presenza del gruppo idrossile (-OH) che gli consente di formare legami idrogeno con altre molecole C4H9OH o con molecole d’acqua.
D: Quanti grammi di alcol butilico (c4h9oh) ci sono in una soluzione da 2500 ml o 2,22 m?
R: Per calcolare il numero di grammi di alcol butilico presenti nella soluzione, dobbiamo utilizzare la formula: moli = concentrazione x volume. La concentrazione della soluzione è 2,22 moli/L e il volume è 2,5 L (2500 ml convertiti in L). Quindi il numero di moli di alcol butilico nella soluzione è: 2,22 x 2,5 = 5,55 moli. Per calcolare la massa dell’alcol butilico, moltiplicare il numero di moli per la sua massa molare (74,12 g/mol): 5,55 x 74,12 = 411,4 g. In una soluzione da 2.500 ml ci sono quindi 411,4 grammi di alcol butilico, ovvero 2,22 M.
