Il 2-butanolo è un liquido incolore e infiammabile con un odore dolce. È comunemente usato come solvente e nella produzione di prodotti chimici come il metiletilchetone e l’acetato di butile.
| Nome IUPAC | 2-butanolo |
| Formula molecolare | C4H10O |
| numero CAS | 78-92-2 |
| Sinonimi | Alcool butilico secco, alcol 2-butilico, butan-2-olo, etilmetilcarbinolo |
| InChI | InChI=1S/C4H10O/c1-3-4(2)5/h4-5H,3H2,1-2H3 |
Proprietà del 2-butanolo
Formula 2-butanolo
La formula chimica del 2-butanolo è C4H10O, il che indica che contiene quattro atomi di carbonio, dieci atomi di idrogeno e un atomo di ossigeno. È un isomero del butanolo e ha una formula strutturale CH3CH(OH)CH2CH3. Il “2” nel nome del composto indica la posizione del gruppo ossidrile sulla catena del carbonio.
Massa molare del 2-butanolo
La massa molare di C4H10O è 74,12 g/mol. Questo valore si ottiene sommando le masse atomiche di tutti gli atomi del composto, che sono 12,01 g/mol per il carbonio, 1,01 g/mol per l’idrogeno e 16,00 g/mol per l’ossigeno. La massa molare è una proprietà importante di C4H10O perché viene utilizzata per calcolare la quantità di composto richiesta nelle reazioni chimiche.
Punto di ebollizione del 2-butanolo
Il punto di ebollizione di C4H10O è 99,5 °C (211,1 °F) a pressione standard (1 atm). Questa è la temperatura alla quale lo stato liquido del composto passa allo stato gassoso. Il punto di ebollizione di C4H10O è superiore a quello del butano (−0,5 °C) e del butene (−6,3 °C) a causa del suo legame idrogeno e del peso molecolare.
Punto di fusione del 2-butanolo
Il punto di fusione di C4H10O è −114,7 ° C (−174,5 ° F). Questa è la temperatura alla quale lo stato solido del composto passa allo stato liquido. Il punto di fusione di C4H10O è inferiore a quello del butano (−138,4 °C) e del butene (−185,3 °C) a causa della sua struttura ramificata e dei legami idrogeno.
Densità del 2-butanolo g/mL
La densità di C4H10O è 0,809 g/mL a 25°C (77°F). Questo valore indica la massa del composto per unità di volume della sostanza. La densità di C4H10O è superiore a quella del butano (0,588 g/mL) e del butene (0,587 g/mL) a causa del suo peso molecolare e delle forze intermolecolari.
Peso molecolare del 2-butanolo
Il peso molecolare di C4H10O è 74,12 g/mol. È la somma dei pesi atomici di tutti gli atomi presenti in una molecola del composto. Il peso molecolare viene utilizzato per calcolare altre proprietà del composto, come la massa molare, il punto di ebollizione e la densità.
Struttura del 2-butanolo
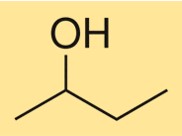
La struttura di C4H10O è caratterizzata da una catena di carbonio ramificata con un gruppo ossidrile attaccato al secondo atomo di carbonio. È un alcol primario con un centro chirale, il che significa che esiste come due stereoisomeri, (R)-C4H10O e (S)-C4H10O. Il composto ha una struttura tridimensionale dovuta alla disposizione tetraedrica degli atomi di carbonio e ossigeno attorno al gruppo ossidrile.
Solubilità del 2-butanolo
C4H10O è un composto polare ed è parzialmente solubile in acqua. La solubilità di C4H10O in acqua è 80 g/L a 25°C (77°F). Il composto è più solubile in solventi organici come etanolo, etere e acetone. La solubilità di C4H10O è influenzata da fattori quali temperatura, pressione e natura del solvente.
| Aspetto | Liquido chiaro |
| Peso specifico | 0,810 g/mL a 25°C (77°F) |
| Colore | Incolore |
| Odore | Caratteristica |
| Massa molare | 74,12 g/mole |
| Densità | 0,809 g/ml a 25°C (77°F) |
| Punto di fusione | −114,7 °C (−174,5 °F) |
| Punto di ebollizione | 99,5°C (211,1°F) alla pressione di 1 atm |
| Punto flash | Tazza chiusa a 39°C (102°F). |
| solubilità in acqua | 80 g/l a 25°C (77°F) |
| Solubilità | Solubile in etanolo, etere e acetone |
| Pressione del vapore | 8,7 mmHg a 25°C (77°F) |
| Densità del vapore | 2,6 (aria = 1) |
| pKa | 16 |
| pH | 7.0-8.5 |
Sicurezza e pericoli del 2-butanolo
C4H10O è considerato un prodotto chimico relativamente sicuro se maneggiato correttamente. Tuttavia, l’esposizione ad elevate concentrazioni può causare irritazione agli occhi, alla pelle e alle vie respiratorie. Può anche causare mal di testa, vertigini e nausea. L’ingestione di C4H10O può causare irritazione gastrointestinale e possibile depressione del sistema nervoso centrale. Inoltre, C4H10O è infiammabile e può rappresentare un pericolo di incendio. Dovrebbe essere conservato in un luogo fresco, asciutto e ben ventilato, lontano da fonti di ignizione. Quando si maneggia questa sostanza chimica è necessario indossare dispositivi di protezione individuale adeguati, come guanti e occhiali protettivi. Le fuoriuscite devono essere ripulite tempestivamente utilizzando procedure appropriate.
| Simboli di pericolo | F, Xi |
| Descrizione della sicurezza | Tenere lontano da fonti di calore/scintille/fiamme libere/superfici calde. Indossare guanti/indumenti protettivi/proteggere gli occhi/il viso. IN CASO DI CONTATTO CON LA PELLE (o con i capelli): rimuovere immediatamente tutti gli indumenti contaminati. Sciacquare la pelle con acqua/fare una doccia. IN CASO DI INALAZIONE: trasportare la vittima all’aria aperta e mantenerla a riposo in una posizione che favorisca la respirazione. IN CASO DI INGESTIONE: Sciacquare la bocca. Non provoca il vomito. Chiama un CENTRO ANTIVELENI o un medico se non ti senti bene. |
| Numeri di identificazione delle Nazioni Unite | ONU1120 |
| Codice SA | 2905.13.00 |
| Classe di pericolo | 3 – Liquidi infiammabili |
| Gruppo di imballaggio | III |
| Tossicità | LD50 (orale, ratto): 4,6 g/kg; LC50 (inalazione, ratto): 2.100 ppm/4 ore |
Metodi per la sintesi del 2-butanolo
Diversi metodi possono essere utilizzati per sintetizzare C4H10O.
Un metodo prevede la riduzione dell’acetone utilizzando boroidruro di sodio in presenza di un catalizzatore di nichel o palladio. La reazione produce una miscela di C4H10O e del suo isomero, isobutanolo, che può essere separato mediante distillazione frazionata.
Un altro metodo prevede l’idratazione dell’1-butene utilizzando acido solforico come catalizzatore. La reazione forma una miscela di C4H10O e dei suoi isomeri, ma il C4H10O desiderato può essere separato mediante distillazione frazionata.
Il processo chimico Reppe prevede l’utilizzo di un catalizzatore di palladio o nichel per far reagire l’acetilene con formaldeide e acqua, con conseguente formazione di alcol vinilico. Questa reazione porta inoltre alla sintesi di C4H10O. L’alcol vinilico subisce quindi idrogenazione per formare C4H10O.
Un altro metodo per sintetizzare C4H10O prevede l’idrogenazione della crotonaldeide in presenza di un catalizzatore di nichel. La reazione produce una miscela di C4H10O e del suo isomero, ma il C4H10O desiderato può essere isolato mediante distillazione frazionata.
Usi del 2-butanolo
C4H10O ha una varietà di applicazioni in diversi settori. Alcuni dei suoi usi sono:
- Solvente: utilizzato come solvente nella produzione di resine, vernici e rivestimenti. Utilizzato anche come solvente per eteri ed esteri di cellulosa.
- Carburante: utilizzato come additivo per biocarburanti grazie alla sua bassa tossicità e all’alto contenuto energetico. È stato dimostrato che ha un’efficienza di combustione maggiore rispetto all’etanolo ed è stato studiato come potenziale alternativa alla benzina.
- Intermedio chimico: utilizzato come materia prima per la produzione di altri prodotti chimici come metil etil chetone, metil isobutil chetone e diisobutilene.
- Profumo e fragranza: utilizzato come fragranza e agente aromatizzante nella produzione di profumi, saponi e altri prodotti per la cura personale.
- Reagente di laboratorio: utilizzato come solvente e reagente negli esperimenti di chimica organica.
- Agente pulente: utilizzato come detergente nei prodotti per la pulizia industriale e domestica.
- Inchiostro da stampa: utilizzato anche come solvente nella produzione di inchiostri da stampa.
Domande:
D: Quale composto carbonilico e reagente di Grignard potrebbero essere utilizzati per preparare il 2-butanolo?
R: Il composto carbonilico che potrebbe essere utilizzato per preparare C4H10O è il butanale (noto anche come n-butirraldeide) e il reagente di Grignard che potrebbe essere utilizzato è il bromuro di etil magnesio. La reazione tra butanale e bromuro di etilmagnesio produce C4H10O come prodotto finale.
D: Il 2-butanolo è polare?
R: Sì, C4H10O è polare. Contiene un gruppo ossidrile (-OH), che è un gruppo funzionale polare che rende la molecola polare.
D: Il 2-butanolo è solubile in acqua?
R: Sì, C4H10O è parzialmente solubile in acqua. Il gruppo ossidrile polare di C4H10O gli consente di formare legami idrogeno con le molecole d’acqua, rendendolo alquanto solubile in acqua.
D: Il 2-butanolo ha un legame idrogeno?
R: Sì, C4H10O può formare legami idrogeno. Il gruppo ossidrile (-OH) in C4H10O può formare legami idrogeno con altre molecole polari contenenti siti di legame idrogeno, come l’acqua.
