Il perclorato di sodio è un composto chimico con la formula NaClO4. È un solido cristallino bianco altamente solubile in acqua e comunemente utilizzato come agente ossidante in vari processi industriali.
| Nome IUPAC | Perclorato di sodio |
| Formula molecolare | NaClO4 |
| numero CAS | 7601-89-0 |
| Sinonimi | Acido perclorico, sale sodico; Perclorato di sodio (francese); Perclorato di sodio (tedesco); Perclorato di sodio (italiano); Perclorato sodico (spagnolo); ONU 1502 |
| InChI | InChI=1S/ClHO4.Na/c2-1(3,4)5;/h(H,2,3,4,5);/q;+1/p-1 |
Proprietà del perclorato di sodio
Formula di perclorato di sodio
La formula chimica del perclorato di sodio è NaClO4. Ciò significa che il composto è costituito da un atomo di sodio, un atomo di cloro e quattro atomi di ossigeno. Il perclorato di sodio è un potente agente ossidante comunemente utilizzato in vari processi industriali.
Massa molare del perclorato di sodio
La massa molare di NaClO4 è 122,44 g/mol. Ciò significa che una mole di NaClO4 contiene 122,44 grammi del composto. La massa molare di un composto è importante per determinare la quantità di sostanza necessaria per una reazione chimica.
Punto di ebollizione del perclorato di sodio
Il punto di ebollizione di NaClO4 è 545°C (1013 hPa). Questa è la temperatura alla quale il composto passa da liquido a gassoso. NaClO4 ha un punto di ebollizione elevato a causa delle forti forze elettrostatiche tra gli ioni sodio e perclorato.
Perclorato di sodio Punto di fusione
Il punto di fusione di NaClO4 è 482°C. Questa è la temperatura alla quale il composto passa dallo stato solido a quello liquido. NaClO4 ha un punto di fusione elevato a causa delle forti forze elettrostatiche tra gli ioni sodio e perclorato.
Densità del perclorato di sodio g/mL
La densità di NaClO4 è 2,52 g/mL. Ciò significa che un millilitro di NaClO4 pesa 2,52 grammi. La densità di una sostanza è importante nel determinare le sue proprietà fisiche, come la galleggiabilità e la viscosità.
Peso molecolare del perclorato di sodio
Il peso molecolare di NaClO4 è 122,44 g/mol. Questa è la somma dei pesi atomici degli atomi di sodio, cloro e ossigeno nel composto. Il peso molecolare di un composto è importante per determinarne le proprietà fisiche e chimiche.
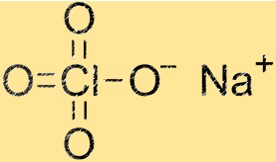
Struttura del perclorato di sodio
La struttura di NaClO4 è un reticolo cristallino composto da cationi Na+ e anioni ClO4-. I cationi di sodio sono circondati da quattro atomi di ossigeno, mentre gli anioni ClO4 sono costituiti da un atomo di cloro e quattro atomi di ossigeno. La struttura del reticolo cristallino conferisce a NaClO4 le sue caratteristiche proprietà fisiche e chimiche.
Solubilità del perclorato di sodio
NaClO4 è altamente solubile in acqua, con una solubilità di 209 g/100 mL a 20°C. Ciò significa che una grande quantità di NaClO4 può dissolversi in una piccola quantità di acqua. L’elevata solubilità di NaClO4 lo rende utile in vari processi industriali, come la produzione di perclorato di ammonio per il carburante per missili.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 2,52 g/ml |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 122,44 g/mole |
| Densità | 2,52 g/ml |
| Punto di fusione | 482°C |
| Punto di ebollizione | 545°C (1013hPa) |
| Punto flash | Non applicabile |
| solubilità in acqua | 209 g/100 ml a 20°C |
| Solubilità | Solubile in acqua ed etanolo |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | Non disponibile |
| pH | Non disponibile |
Sicurezza e pericoli del perclorato di sodio
NaClO4 è un composto pericoloso che deve essere maneggiato con cura. È un forte agente ossidante che può reagire violentemente con materiali organici, agenti riducenti e altri prodotti chimici. L’esposizione alla polvere o ai vapori di NaClO4 può causare irritazione agli occhi, alla pelle e al sistema respiratorio. L’ingestione di NaClO4 può causare irritazione gastrointestinale, nausea e vomito. NaClO4 è anche dannoso per la vita acquatica e deve essere smaltito correttamente. Durante la manipolazione di NaClO4 è necessario indossare dispositivi di protezione individuale come guanti, occhiali e un respiratore per evitare l’esposizione. Anche una ventilazione e uno stoccaggio adeguati sono importanti per ridurre al minimo il rischio di incidenti.
| Simboli di pericolo | O, Xn |
| Descrizione della sicurezza | Non respirare la polvere/i fumi/i gas/la nebbia/i vapori/gli aerosol. Indossare guanti/indumenti protettivi/proteggere gli occhi/il viso. IN CASO DI INALAZIONE: trasportare la vittima all’aria aperta e mantenerla a riposo in una posizione che favorisca la respirazione. IN CASO DI INGESTIONE: Sciacquare la bocca. Non provoca il vomito. Chiama un CENTRO ANTIVELENI o un medico se non ti senti bene. |
| Numeri di identificazione delle Nazioni Unite | UN1502 |
| Codice SA | 2829.90.90 |
| Classe di pericolo | 5.1 |
| Gruppo di imballaggio | II |
| Tossicità | Tossico se ingerito, nocivo se inalato o a contatto con la pelle. Può causare irritazione o corrosione. |
Metodi per la sintesi del perclorato di sodio
Vari metodi possono sintetizzare NaClO4.
Un metodo comune prevede la reazione del clorato di sodio con l’acido cloridrico , con conseguente formazione di NaClO4 e cloruro di sodio .
Un altro metodo prevede l’elettrolisi di una soluzione di cloruro di sodio in presenza di un sale perclorato. Avviene la conversione del cloruro di sodio in clorato di sodio, seguita dall’aggiunta di acido cloridrico, che lo converte in NaClO4.
Un altro approccio consiste nel far reagire il clorato di sodio con il cloruro di sodio in presenza di acido solforico. Questo metodo produce una miscela di NaClO4 e solfato di sodio, che può essere separata mediante cristallizzazione frazionata.
Un altro metodo prevede la reazione del clorato di sodio con il perclorato di ammonio, che produce NaClO4 e cloruro di ammonio. La produzione di NaClO4, comunemente usato come ossidante nei propellenti solidi per razzi, prevede l’uso di questo metodo.
Anche la reazione dell’ipoclorito di sodio con il clorato di sodio in presenza di acido cloridrico sintetizza NaClO4. Questo metodo produce NaClO4 e cloruro di sodio come prodotti principali.
Usi del perclorato di sodio
NaClO4 ha vari usi in diversi settori. Ecco alcune applicazioni comuni di NaClO4:
- Propellenti per razzi: comunemente usati come ossidanti nei propellenti solidi per razzi a causa del loro alto contenuto di ossigeno e dell’elevata stabilità.
- Pirotecnica: utilizzato come ossidante nelle composizioni pirotecniche come razzi, fuochi d’artificio e razzi.
- Chimica analitica: utilizzato come fonte di ioni perclorato in chimica analitica per la determinazione degli ioni in vari campioni.
- Galvanotecnica: utilizzato come componente nelle soluzioni galvaniche per migliorare la conduttività e la stabilità del bagno galvanico.
- Batterie: utilizzato come elettrolita nelle batterie agli ioni di litio, grazie alla sua elevata solubilità e capacità di migliorare le proprietà elettrochimiche della batteria.
- Applicazioni mediche: utilizzato nel trattamento dei disturbi della tiroide come inibitore competitivo del trasporto di iodio. Utilizzato anche nella produzione di agenti di contrasto per l’imaging medico.
- Trattamento dell’acqua: utilizzato nel trattamento dell’acqua come disinfettante e per rimuovere alcuni contaminanti dall’acqua.
Domande:
D: Qual è la formula del perclorato di sodio?
R: NaClO4.
D: Il perclorato di sodio è solubile in acqua?
R: Sì, NaClO4 è altamente solubile in acqua.
D: Il perclorato di sodio è un acido o una base?
R: NaClO4 non è né un acido né una base. È sale.
D: Qual è la reazione tra perclorato di ammonio e bromuro di sodio?
R: La reazione è: NH4ClO4 + NaBr → NaClO4 + NH4Br.
D: Quanti ioni sodio ci sono nel perclorato di sodio?
R: C’è uno ione sodio in NaClO4.
D: NaClO4 è un acido o una base?
R: NaClO4 non è né un acido né una base. È un sale.
D: Quali specie disciolte sono presenti in una soluzione di NaClO4?
R: In una soluzione NaClO4, le specie disciolte sono gli ioni Na+ e ClO4-.
D: Quante moli di ossigeno ci sono in 3,30 moli di NaClO4?
R: Ci sono 13,2 moli di ossigeno in 3,30 moli di NaClO4.
D: NaClO4 è solubile in acqua?
R: Sì, NaClO4 è altamente solubile in acqua.
D: Quante moli di ossigeno ci sono in 1,10 moli di NaClO4?
R: Ci sono 4,4 moli di ossigeno in 1,10 moli di NaClO4.
