Il clorato di magnesio (Mg(ClO3)2) è un composto composto da ioni Mg2+ e ClO3-. È una polvere cristallina bianca solubile in acqua e altamente reattiva. Può essere utilizzato come agente ossidante nella produzione di fuochi d’artificio e come disinfettante nel trattamento dell’acqua.
| Nome IUPAC | Clorato di magnesio |
| Formula molecolare | Mg(ClO3)2 |
| numero CAS | 10326-21-3 |
| Sinonimi | Diperclorato di magnesio, clorato di magnesio (II), clorato di magnesio esaidrato |
| InChI | InChI=1S/2ClHO3.Mg/c2 2-1(3)4;/h2 (H,2,3,4);/q;;+2/p-2 |
Proprietà del clorato di magnesio
Formula di clorato di magnesio
Il clorato di magnesio è un composto chimico con la formula Mg(ClO3)2. Il composto è composto da uno ione magnesio (Mg2+) e due ioni ClO3. La formula chimica afferma che una molecola di clorato di magnesio contiene due ioni cloruro e sei atomi di ossigeno.
Massa molare del clorato di magnesio
La massa molare di Mg(ClO3)2 è 191,2 g/mol. Questo valore si calcola sommando i pesi atomici degli elementi presenti in una molecola di Mg(ClO3)2. Il magnesio ha una massa molare di 24,31 g/mol, mentre il cloro e l’ossigeno hanno masse molari di 35,45 g/mol e 16,00 g/mol, rispettivamente. Moltiplicando la massa molare di ciascun elemento per il numero di atomi di quell’elemento nella molecola e sommandoli, otteniamo la massa molare del composto.
Punto di ebollizione del clorato di magnesio
Mg(ClO3)2 si decompone prima di raggiungere il punto di ebollizione. Quando riscaldato, Mg(ClO3)2 si decompone in cloruro di magnesio, ossigeno gassoso e cloro gassoso. Pertanto, Mg(ClO3)2 non ha punto di ebollizione.
Clorato di magnesio Punto di fusione
Il punto di fusione di Mg(ClO3)2 è 105°C. A questa temperatura il composto solido si trasforma in forma liquida. Il punto di fusione di Mg(ClO3)2 può variare a seconda della purezza del composto e delle condizioni in cui viene misurato.
Densità del clorato di magnesio g/mL
La densità di Mg(ClO3)2 è 2,21 g/mL. Ciò significa che un millilitro di Mg(ClO3)2 ha una massa di 2,21 grammi. La densità di Mg(ClO3)2 può essere utilizzata per calcolare il volume di una data massa del composto o la massa di un dato volume del composto.
Peso molecolare del clorato di magnesio
Il peso molecolare di Mg(ClO3)2 è 191,2 g/mol. Questo valore si calcola sommando i pesi atomici degli elementi presenti in una molecola di Mg(ClO3)2.
Struttura del clorato di magnesio
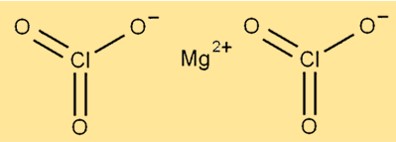
La struttura di Mg(ClO3)2 è composta da ioni magnesio circondati da sei atomi di ossigeno e due atomi di cloro. Lo ione magnesio si trova al centro della molecola, mentre attorno ad esso sono disposti gli atomi di ossigeno e cloro. Il composto ha una struttura cristallina ed è di colore bianco.
Solubilità del clorato di magnesio
Mg(ClO3)2 è solubile in acqua, etanolo e acetone. La solubilità di Mg(ClO3)2 in acqua aumenta con la temperatura. A temperatura ambiente, circa 31 grammi di Mg(ClO3)2 si possono sciogliere in 100 ml di acqua. La solubilità di Mg(ClO3)2 in altri solventi dipende dalla polarità del solvente.
| Aspetto | Polvere cristallina bianca |
| Peso specifico | 2,21 g/cm3 |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 191,2 g/mole |
| Densità | 2,21 g/ml |
| Punto di fusione | 105°C |
| Punto di ebollizione | Si rompe prima dell’ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | Solubile |
| Solubilità | Solubile in acqua, etanolo e acetone |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Non applicabile |
Sicurezza e pericoli del clorato di magnesio
Mg(ClO3)2 è un forte agente ossidante e può reagire violentemente con materiali combustibili, provocando incendi o esplosioni. Può anche causare irritazione alla pelle, agli occhi e al sistema respiratorio per contatto o inalazione. Pertanto, quando si maneggia Mg(ClO3)2 è necessario utilizzare dispositivi di protezione individuale adeguati, come guanti e occhiali protettivi. Il composto deve inoltre essere conservato lontano da materiali combustibili e fonti di calore o ignizione. Inoltre, deve essere fornita un’adeguata ventilazione per prevenire l’inalazione di polvere o vapori dal composto. Mg(ClO3)2 deve essere maneggiato con cautela per evitare potenziali pericoli.
| Simboli di pericolo | Ossidante |
| Descrizione della sicurezza | Evitare il contatto con materiali combustibili, indossare guanti e occhiali protettivi, garantire un’adeguata ventilazione |
| Numeri di identificazione delle Nazioni Unite | UN1475 |
| Codice SA | 2829.90.90 |
| Classe di pericolo | 5.1 |
| Gruppo di imballaggio | II |
| Tossicità | Può causare irritazione alla pelle, agli occhi e alle vie respiratorie; può essere nocivo se ingerito |
Metodi di sintesi del clorato di magnesio
Possono essere utilizzati diversi metodi per sintetizzare Mg(ClO3)2.
Un metodo comune consiste nel far reagire l’idrossido di magnesio con l’acido clorico. La reazione procede come segue:
Mg(OH)2 + 2HClO3 → Mg(ClO3)2 + 2H2O
Un altro metodo consiste nel far reagire il carbonato di magnesio con l’acido perclorico. La reazione procede come segue:
MgCO3 + 2HClO4 → Mg(ClO4)2 + CO2 + H2O
Un terzo metodo prevede l’elettrolisi del cloruro di magnesio in presenza di un sale clorato, come clorato di sodio o di potassio. La reazione procede come segue:
2MgCl2 + 2NaClO3 → Mg(ClO3)2 + 2NaCl
In questo metodo, il processo di elettrolisi utilizza un anodo di magnesio e utilizza il sale clorato come agente ossidante.
Usi del clorato di magnesio
Mg(ClO3)2 ha vari usi in diversi campi. Ecco alcune delle sue applicazioni:
- Prodotti pirotecnici: comunemente usati come ossidante nelle composizioni pirotecniche, come razzi, fuochi d’artificio e dispositivi di segnalazione.
- Sintesi chimica: utilizzato come fonte di ossigeno nella sintesi di vari prodotti chimici, inclusi prodotti farmaceutici, coloranti ed esplosivi.
- Candeggina: utilizzata come agente sbiancante nella produzione di carta, pasta di legno e tessuti.
- Trattamento dell’acqua: utilizzato anche come agente di trattamento dell’acqua per rimuovere impurità e batteri presenti nell’acqua.
- Reagente di laboratorio: utilizzato come reagente di laboratorio in vari metodi di chimica analitica.
- Agricoltura: utilizzato come fertilizzante e ammendante per fornire magnesio e ossigeno alle piante.
- Industria petrolifera e del gas: utilizzato come ossidante nelle operazioni di perforazione e brillamento nell’industria petrolifera e del gas.
Domande:
D: Qual è la formula del clorato di magnesio?
R: Mg(ClO3)2.
D: Quanti atomi ci sono in 2,1 moli di Mg(ClO3)2?
R: Ci sono 5,04 x 10^24 atomi in 2,1 moli di Mg(ClO3)2.
D: In cosa si scompone il clorato di magnesio?
R: Mg(ClO3)2 può trasformarsi in cloruro di magnesio, ossigeno gassoso e cloro gassoso quando riscaldato.
D: Come si scompone il clorato di magnesio?
R: Mg(ClO3)2 si decompone in cloruro di magnesio e ossigeno gassoso quando riscaldato.
D: Qual è il numero totale di atomi di ossigeno presenti in un’unità di Mg(ClO3)2?
R: In un’unità di Mg(ClO3)2 sono presenti 6 atomi di ossigeno.
D: In cosa si scompone il Mg(ClO3)2?
R: Mg(ClO3)2 si decompone per formare MgCl2 e O2 quando riscaldato.
D: Qual è il numero totale di moli di atomi di ossigeno presenti in una mole di Mg(ClO3)2?
R: In una mole di Mg(ClO3)2 sono presenti 6 moli di atomi di ossigeno.
D: Qual è la massa in grammi di Mg(ClO3)2?
R: La massa formula in grammi di Mg(ClO3)2 è 232,21 g/mol.
D: Mg(ClO3)2 è ionico o molecolare?
R: Mg(ClO3)2 è un composto ionico.
