Il clorato di sodio è un composto chimico con la formula NaClO3. È un potente agente ossidante comunemente utilizzato nella produzione di fiammiferi, coloranti ed erbicidi.
| Nome IUPAC | Clorato di sodio |
| Formula molecolare | NaClO3 |
| numero CAS | 7775-09-9 |
| Sinonimi | Acido clorico, sale sodico; Naclo3; Acido clorico, sale sodico (1:1); ONU1495; Clorato di sodio; Cloruro di sodio; |
| InChI | InChI=1S/ClHO3.Na/c2-1(3)4;/h(H,2,3,4);/q;+1/p-1 |
Proprietà del clorato di sodio
Formula di clorato di sodio
La formula chimica del clorato di sodio è NaClO3. È un composto ionico composto da uno ione Na+ e uno ione ClO3-. Lo ione Na+ ha una carica positiva, mentre lo ione ClO3- ha una carica negativa. La formula indica che uno ione Na+ è combinato con uno ione ClO3- per formare il composto.
Massa molare del clorato di sodio
La massa molare di NaClO3 è 106,44 g/mol. Questa è la massa di una mole del composto, che contiene il numero di molecole di Avogadro (6,022 x 10^23). Si calcola sommando le masse atomiche di tutti gli atomi presenti nel composto.
Punto di ebollizione del clorato di sodio
Il punto di ebollizione di NaClO3 è 300°C (572°F). Questa è la temperatura alla quale il composto passa da liquido a gassoso. Il punto di ebollizione è determinato dalla forza delle forze intermolecolari tra le molecole.
Punto di fusione del clorato di sodio
Il punto di fusione di NaClO3 è 248°C (478°F). Questa è la temperatura alla quale il composto passa dallo stato solido a quello liquido. Il punto di fusione è determinato dalla forza delle forze intermolecolari tra le molecole.
Densità del clorato di sodio g/mL
La densità di NaClO3 è 2,49 g/mL. È la massa del composto per unità di volume. La densità è determinata dalla massa e dal volume della sostanza.
Peso molecolare del clorato di sodio
Il peso molecolare di NaClO3 è 106,44 g/mol. È la somma dei pesi atomici di tutti gli atomi presenti nel composto.
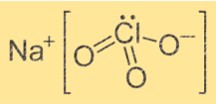
Struttura del clorato di sodio
La struttura di NaClO3 è cristallina. Lo ione Na+ è circondato da sei atomi di ossigeno provenienti da sei diversi ioni ClO3-. Gli ioni ClO3- formano una forma tetraedrica attorno allo ione Na+. La struttura è tenuta insieme da legami ionici tra lo ione Na+ e gli ioni ClO3-.
Solubilità del clorato di sodio
NaClO3 è solubile in acqua, etanolo e metanolo. Si dissolve facilmente in acqua per formare una soluzione limpida e incolore. La solubilità di NaClO3 in acqua aumenta con la temperatura. A 20°C la solubilità è di 85 g/100 mL di acqua.
| Aspetto | Solido bianco |
| Peso specifico | 2,49 g/cm³ |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 106,44 g/mole |
| Densità | 2,49 g/ml |
| Punto di fusione | 248°C (478°F) |
| Punto di ebollizione | 300°C (572°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | 85 g/100 ml |
| Solubilità | Solubile in acqua, etanolo e metanolo |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Neutro (7) |
Sicurezza e pericoli del clorato di sodio
NaClO3 è un forte agente ossidante e deve essere maneggiato con cura. Esiste un potenziale rischio di incendio ed esplosione quando entra in contatto con materiali organici come carta, legno o olio. Può reagire violentemente anche con agenti riducenti, acidi e polveri metalliche. L’ingestione o l’inalazione di NaClO3 può causare gravi effetti sulla salute, come problemi respiratori, dolori addominali e vomito. NaClO3 può anche irritare la pelle, gli occhi e il sistema respiratorio. Quando si lavora con NaClO3 è necessario indossare dispositivi di protezione adeguati, inclusi guanti, occhiali e un respiratore, per evitare l’esposizione e potenziali pericoli.
| Simboli di pericolo | Agente ossidante |
| Descrizione della sicurezza | Nocivo se ingerito, provoca grave irritazione agli occhi, può causare irritazione delle vie respiratorie |
| Numeri di identificazione delle Nazioni Unite | ONU 1495 |
| Codice SA | 2829.19.00 |
| Classe di pericolo | 5.1 (Materiali ossidanti) |
| Gruppo di imballaggio | II |
| Tossicità | Tossico se ingerito o inalato, irritante per la pelle e gli occhi |
Metodi per la sintesi del clorato di sodio
Esistono diversi metodi per sintetizzare NaClO3.
Un metodo comune consiste nell’elettrolizzare una soluzione di cloruro di sodio . Ciò comporta il passaggio di una corrente elettrica attraverso la soluzione, che provoca la scomposizione del cloruro di sodio in NaClO3 e cloro gassoso. Un altro metodo prevede la reazione dell’idrossido di sodio con il cloro gassoso per formare NaClO3 e cloruro di sodio.
Un terzo metodo prevede la reazione del carbonato di sodio con il cloro gassoso in presenza di un catalizzatore. Questo produce NaClO3, cloruro di sodio e anidride carbonica. In alternativa, la reazione tra ipoclorito di sodio e idrossido di sodio può produrre NaClO3. Questa reazione porta alla formazione di NaClO3, cloruro di sodio e acqua.
Oltre a questi metodi, NaClO3 può essere prodotto anche mediante la reazione del clorito di sodio con il perossido di idrogeno. Questa reazione porta alla formazione di NaClO3, acqua e ossigeno gassoso.
Usi del clorato di sodio
NaClO3 ha vari usi in vari settori. Alcuni dei suoi usi comuni includono:
- Erbicida: ampiamente utilizzato come erbicida, soprattutto per il controllo delle erbe infestanti nelle aree incolte come bordi stradali, linee ferroviarie e linee elettriche. Interrompendo la fotosintesi delle piante, può controllare efficacemente varie erbe infestanti.
- Candeggina: utilizzata nell’industria della pasta di legno e della carta come agente sbiancante. È particolarmente efficace nella produzione di carta bianca brillante di alta qualità.
- Estrazione mineraria: utilizzato nell’industria mineraria come agente ossidante per l’estrazione dell’oro e di altri metalli preziosi.
- Esplosivi: utilizzati come ingrediente nella produzione di esplosivi come dinamite e clorato di ammonio.
- Coloranti e pigmenti: utilizzati nella produzione di coloranti e pigmenti, in particolare per la colorazione dei tessuti.
- Laboratorio: utilizzato in laboratorio come reagente per varie reazioni chimiche.
- Trattamento dell’acqua: utilizzato nel trattamento dell’acqua per controllare la crescita delle alghe e come disinfettante.
- Conservante alimentare: utilizzato anche come conservante alimentare per prolungare la durata di conservazione di alcuni alimenti.
Domande:
D: Come produrre il clorato di sodio?
R: NaClO3 può essere prodotto con diversi metodi come l’elettrolisi della soluzione di cloruro di sodio, la reazione dell’idrossido di sodio con il cloro gassoso e la reazione del carbonato di sodio con il cloro gassoso in presenza di un catalizzatore.
D: Quanto tempo impiega il clorato di sodio per uccidere le erbacce?
R: NaClO3 è un potente erbicida e può uccidere le erbacce entro pochi giorni dall’applicazione. Il tempo necessario per uccidere le infestanti può variare a seconda di fattori quali la concentrazione di NaClO3 utilizzata e il tipo di infestante preso di mira.
D: Il clorato di sodio è una sostanza pura?
R: Sì, NaClO3 è una sostanza pura perché è un composto costituito solo da atomi di sodio, cloro e ossigeno.
D: Il clorato di sodio è solubile in acqua?
R: Sì, NaClO3 è altamente solubile in acqua. Può dissolversi in acqua per formare una soluzione limpida e incolore.
D: Quanti atomi di ossigeno ci sono in una molecola di clorato di sodio?
R: Una molecola di NaClO3 ha tre atomi di ossigeno. La sua formula chimica è NaClO3.
D: Il clorato di sodio è ionico o covalente?
R: NaClO3 è un composto ionico. Si forma mediante il trasferimento di elettroni dagli atomi di sodio agli atomi di cloro per formare ioni Na+ con carica positiva e ioni NaClO3 con carica negativa.
