L’ipoclorito di potassio (KClO) è un composto chimico comunemente usato come disinfettante e candeggina. Ha un odore forte e può essere pericoloso se non maneggiato correttamente.
| Nome IUPAC | Ipoclorito di potassio |
| Formula molecolare | KClO |
| numero CAS | 7778-66-7 |
| Sinonimi | Acido ipocloroso, sale di potassio; Ossicloruro di potassio; Clorato di potassio(I) |
| InChI | InChI=1S/ClO.K/h1H;/q;+1/p-1 |
Proprietà dell’ipoclorito di potassio
Formula di ipoclorito di potassio
La formula chimica dell’ipoclorito di potassio è KClO. È costituito da uno ione di potassio, un atomo di cloro e un atomo di ossigeno. L’ipoclorito di potassio è un solido bianco a temperatura ambiente e ha un forte odore di cloro. È comunemente usato come disinfettante e agente sbiancante in vari settori.
Massa molare dell’ipoclorito di potassio
La massa molare di KClO è 90,55 g/mol. È la somma delle masse atomiche degli elementi costitutivi potassio, cloro e ossigeno. La massa molare è un parametro importante utilizzato nella stechiometria e in altri calcoli chimici.
Punto di ebollizione dell’ipoclorito di potassio
KClO si decompone prima di raggiungere il punto di ebollizione. Il suo punto di ebollizione non è quindi ben definito. Quando riscaldato, si decompone in cloruro di potassio e ossigeno gassoso. La decomposizione di KClO è una reazione esotermica e può essere pericolosa se non gestita correttamente.
Ipoclorito di potassio Punto di fusione
Il punto di fusione del KClO è compreso tra 100 e 102°C. È un solido bianco a temperatura ambiente e si scioglie quando riscaldato. Il punto di fusione è un’importante proprietà fisica di una sostanza e viene utilizzato per identificare e caratterizzare la sostanza.
Densità dell’ipoclorito di potassio g/ml
La densità di KClO è 2,35 g/mL. Ciò significa che un millilitro di KClO pesa 2,35 grammi. La densità è una misura della massa per unità di volume di una sostanza ed è un parametro importante nei calcoli chimici.
Peso Molecolare dell’Ipoclorito di Potassio
Il peso molecolare di KClO è 90,55 g/mol. È la somma dei pesi atomici degli elementi costitutivi di una molecola di KClO. Il peso molecolare viene utilizzato nei calcoli chimici come la determinazione della massa molare e della stechiometria.
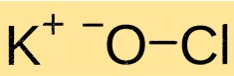
Struttura dell’ipoclorito di potassio
KClO ha una struttura cristallina. È costituito da cationi K+ e anioni ClO- tenuti insieme da legami ionici. La struttura del KClO è simile a quella di altri composti ionici ed è determinata dalla carica e dalla dimensione degli ioni costituenti.
Solubilità dell’ipoclorito di potassio
KClO è molto solubile in acqua. Forma una soluzione di cationi K+ e anioni ClO- quando disciolto in acqua. La solubilità di KClO in acqua è influenzata dalla temperatura e dal pH. Temperature più elevate e valori di pH più bassi aumentano la solubilità di KClO in acqua.
| Aspetto | Solido bianco |
| Peso specifico | 2.35 |
| Colore | Bianco |
| Odore | Forte odore di cloro |
| Massa molare | 90,55 g/mole |
| Densità | 2,35 g/ml |
| Punto di fusione | 100-102°C |
| Punto di ebollizione | Si decompone prima del punto di ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile |
| Solubilità | Solubile in acqua |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Alcalino (pH 11-13) |
Sicurezza e pericoli dell’ipoclorito di potassio
Il KClO può essere pericoloso se non maneggiato correttamente. È un potente agente ossidante che può reagire con materiali organici per produrre composti pericolosi. Il KClO è anche un potente irritante per la pelle, gli occhi e il sistema respiratorio. Il contatto diretto con la pelle può causare ustioni e irritazioni. L’inalazione di vapori di KClO può causare tosse, respiro sibilante e mancanza di respiro. Il composto deve essere maneggiato in un’area ben ventilata, con adeguati dispositivi di protezione individuale come guanti, occhiali e un respiratore. In caso di esposizione accidentale, è necessario consultare immediatamente un medico.
| Simboli di pericolo | Ossidante |
| Descrizione della sicurezza | Indossare guanti e proteggere gli occhi/il viso. Tenere lontano da materiali combustibili. Evitare il contatto con la pelle e gli occhi. |
| Numeri di identificazione delle Nazioni Unite | ONU1748 |
| Codice SA | 2828.90.10 |
| Classe di pericolo | 5.1 |
| Gruppo di imballaggio | II |
| Tossicità | Può essere nocivo se ingerito. Provoca gravi ustioni cutanee e lesioni oculari. Può causare irritazione respiratoria. |
Metodi per la sintesi dell’ipoclorito di potassio
Esistono vari metodi per sintetizzare l’ipoclorito di potassio.
Un metodo comune consiste nel far reagire il cloro gassoso con una soluzione di idrossido di potassio . La reazione produce KClO e cloruro di potassio come sottoprodotti:
Cl2 + 2KOH → KCl + KClO + H2O
Un altro metodo prevede la reazione dell’ipoclorito di calcio con cloruro di potassio . Questa reazione produce KClO e cloruro di calcio come sottoprodotti:
Ca(ClO)2 + 2 KCl → 2 KClO + CaCl2
Per sintetizzare KClO, l’acido ipocloroso può essere fatto reagire con idrossido di potassio .
2 KOH + HOCl → KClO + KCl + H2O
Per produrre KClO, l’elettrolisi può essere utilizzata per far passare una corrente elettrica attraverso una soluzione di acqua e cloruro di potassio. La reazione produce KClO, gas idrogeno e idrossido di potassio come sottoprodotti:
2 KCl + 2 H2O → 2 KOH + Cl2 + H2
Il KClO sintetizzato deve essere conservato in un luogo fresco e asciutto, lontano dalla luce solare diretta e dal calore.
Usi dell’ipoclorito di potassio
KClO ha vari usi in vari settori e applicazioni. Ecco alcuni dei suoi usi comuni:
- Trattamento dell’acqua: utilizzato come disinfettante negli impianti di trattamento dell’acqua per uccidere batteri e altri organismi nocivi.
- Candeggina: utilizzata come agente sbiancante nell’industria tessile per sbiancare i tessuti.
- Disinfettante: utilizzato come disinfettante nell’industria alimentare per disinfettare le superfici e le attrezzature a contatto con gli alimenti.
- Manutenzione della piscina: utilizzato come disinfettante e alghicida nelle piscine per mantenere l’acqua pulita e limpida.
- Sterilizzazione: utilizzato per la sterilizzazione in ambienti medici e laboratori per disinfettare attrezzature e superfici.
- Deodorante: utilizzato come deodorante negli impianti di trattamento delle acque reflue per neutralizzare gli odori sgradevoli.
- Industria della pasta di legno e della carta: utilizzato nell’industria della pasta di legno e della carta come candeggina per i prodotti di carta.
- Agricoltura: utilizzato in agricoltura come pesticida e fungicida per proteggere le colture da parassiti e malattie.
- Disinfettante: utilizzato come disinfettante nei prodotti per la pulizia della casa per uccidere germi e batteri.
- Industria petrolifera e del gas: utilizzato nell’industria petrolifera e del gas per trattare pozzi petroliferi e oleodotti per controllare i batteri e prevenire la corrosione.
Domande:
D: Cos’è l’ipoclorito di potassio?
R: L’ipoclorito di potassio è un composto chimico con la formula KClO, comunemente usato come disinfettante, candeggina e prodotto chimico per il trattamento dell’acqua.
D: Qual è il pH di una soluzione di KClO 0,42 M? [Ka(HClO) = 4,0 × 10–8]
R: Il pH di una soluzione 0,42 M di KClO può essere calcolato utilizzando il valore Ka del suo acido coniugato, HClO. Il pH è intorno a 12,69.
D: Cos’è l’ipoclorito di sodio e l’idrossido di potassio?
R: L’ipoclorito di sodio è un composto chimico con la formula NaClO, comunemente usato come candeggina e disinfettante. L’idrossido di potassio è un composto chimico con la formula KOH, comunemente usato nella produzione di sapone e come reagente di laboratorio.
D: Qual è il pH di una soluzione acquosa 0,116 M di KClO?
R: Il pH di una soluzione acquosa 0,116 M di KClO può essere calcolato utilizzando il valore Kb della sua base coniugata, ClO-. Il pH è intorno a 11,31.
D: Qual è il pH di una soluzione acquosa 0,191 M di KClO?
R: Il pH di una soluzione acquosa 0,191 M di KClO può essere calcolato utilizzando il valore Kb della sua base coniugata, ClO-. Il pH è intorno a 11,92.
D: KClO è solubile?
R: Sì, KClO è solubile in acqua e forma una soluzione alcalina.
D: Posso mescolare ipoclorito di sodio e ipoclorito di potassio?
R: La miscelazione di ipoclorito di sodio e KClO non è consigliata perché può causare una reazione chimica che produce calore, gas e sottoprodotti potenzialmente dannosi.
