Il bisolfito di magnesio (Mg(HSO3)2) è un composto chimico composto da magnesio, zolfo e ossigeno. È comunemente usato nell’industria alimentare come conservante e antiossidante per prevenire il deterioramento e lo scolorimento.
| Nome IUPAC | Idrogeno solforato di magnesio |
| Formula molecolare | Mg(HSO3)2 |
| numero CAS | 13774-25-9 |
| Sinonimi | Bisolfito di magnesio; Idrogenosolfito di magnesio; Bisolfito di magnesia |
| InChI | InChI=1S/2H2O3S.Mg/c2 1-4(2)3;/h2 (H2,1,2,3);/q;;+2/p-2 |
Proprietà del bisolfito di magnesio
Formula di bisolfito di magnesio
La formula chimica del bisolfito di magnesio è Mg(HSO3)2. La formula rappresenta il numero di atomi di ciascun elemento presente in una molecola del composto. La formula del bisolfito di magnesio è essenziale per determinare le reazioni chimiche che il composto può subire.
Massa molare del bisolfito di magnesio
Mg(HSO3)2 ha una massa molare di 186,45 g/mol. Questo valore rappresenta il peso di una mole del composto in grammi. La massa molare di un composto è essenziale per determinare la quantità di sostanza necessaria per effettuare reazioni chimiche. La massa molare di Mg(HSO3)2 viene calcolata sommando i pesi atomici di ciascun elemento nel composto. Il magnesio ha un peso atomico di 24,305 g/mol, lo zolfo ha un peso atomico di 32,06 g/mol e l’ossigeno ha un peso atomico di 15,999 g/mol.
Punto di ebollizione del bisolfito di magnesio
Mg(HSO3)2 non ha punto di ebollizione perché si decompone quando riscaldato. Tuttavia, può rilasciare anidride solforosa e triossido di zolfo se riscaldato in presenza di un acido. Questi gas possono irritare il sistema respiratorio e causare gravi effetti sulla salute se inalati. È quindi essenziale maneggiare con attenzione il Mg(HSO3)2 e seguire le precauzioni di sicurezza quando lo si utilizza nei processi industriali.
Bisolfito di magnesio Punto di fusione
Mg(HSO3)2 ha un punto di fusione di 110°C. Questo valore rappresenta la temperatura alla quale il composto passa dallo stato solido a quello liquido. Mg(HSO3)2 ha un basso punto di fusione, che lo rende facile da fondere e utilizzare in vari processi industriali. Tuttavia, può decomporsi ad alte temperature, provocando il rilascio di gas nocivi.
Densità del bisolfito di magnesio g/mL
Mg(HSO3)2 ha una densità di 2,35 g/mL. Questo valore rappresenta la quantità di massa in grammi presente in un millilitro del composto. La densità di Mg(HSO3)2 è maggiore di quella dell’acqua, che ha una densità di 1 g/mL. L’elevata densità di Mg(HSO3)2 lo rende utile in varie applicazioni, incluso come conservante e antiossidante nell’industria alimentare.
Peso molecolare del bisolfito di magnesio
Mg(HSO3)2 ha un peso molecolare di 186,45 g/mol. Questo valore rappresenta la somma dei pesi atomici di tutti gli atomi presenti nel composto. Il peso molecolare di Mg(HSO3)2 è essenziale per determinare la quantità di composto necessaria per effettuare reazioni chimiche.
Struttura del bisolfito di magnesio
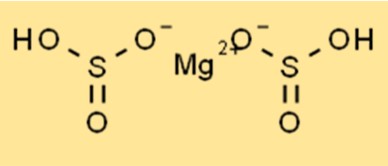
Mg(HSO3)2 ha una struttura cristallina e appartiene al sistema cristallino ortorombico. Il composto è costituito da cationi magnesio (Mg2+) e anioni bisolfito (HSO3-). Gli anioni bisolfito hanno forma tetraedrica, mentre i cationi magnesio sono di forma ottaedrica. La struttura cristallina di Mg(HSO3)2 lo rende stabile e ne consente l’utilizzo in varie applicazioni, incluso come conservante alimentare.
Solubilità del bisolfito di magnesio
Mg(HSO3)2 è altamente solubile in acqua, con una solubilità di circa 64 g/100 mL a 20°C. È anche solubile in metanolo, ma insolubile nella maggior parte dei solventi organici. La solubilità di Mg(HSO3)2 può variare a seconda di fattori quali temperatura e pH.
| Aspetto | polvere bianca |
| Peso specifico | 2,35 g/cm3 |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 186,45 g/mole |
| Densità | 2,35 g/ml |
| Punto di fusione | 110°C |
| Punto di ebollizione | Decomposto |
| Punto flash | Non applicabile |
| solubilità in acqua | Solubile |
| Solubilità | Solubile in acqua ed etanolo |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | 1.91 |
| pH | 4.5 – 5.5 |
Sicurezza e pericoli del bisolfito di magnesio
Il Mg(HSO3)2 può comportare numerosi rischi per la salute e la sicurezza se non maneggiato con cura. Può rilasciare gas di anidride solforosa e triossido di zolfo se riscaldato o esposto a condizioni acide. Se inalati, questi gas possono causare irritazione respiratoria, tosse e mancanza di respiro. Il Mg(HSO3)2 può anche causare irritazione alla pelle e arrossamento al contatto. È essenziale indossare indumenti e attrezzature protettivi, come guanti e occhiali, quando si maneggia Mg(HSO3)2. Inoltre, deve essere conservato in un luogo fresco e asciutto, lontano da fonti di calore e materiali incompatibili. Procedure corrette di manipolazione e conservazione possono ridurre al minimo il rischio di pericoli associati al Mg(HSO3)2.
| Simboli di pericolo | Xi: Irritante |
| Descrizione della sicurezza | Evitare il contatto con la pelle e gli occhi. Indossare indumenti e attrezzature protettive. Tenere lontano da fonti di calore e materiali incompatibili. |
| Numeri di identificazione delle Nazioni Unite | ONU 2693 |
| Codice SA | 2831.10.00 |
| Classe di pericolo | 8 – Sostanze corrosive |
| Gruppo di imballaggio | III |
| Tossicità | Può causare irritazione alla pelle e agli occhi. Nocivo se inalato o ingerito. Può causare irritazione delle vie respiratorie e tosse. |
Metodi di sintesi del bisolfito di magnesio
Mg(HSO3)2 può essere sintetizzato con vari metodi, tra cui:
- Reazione dell’idrossido di magnesio con l’anidride solforosa: Nella reazione dell’idrossido di magnesio con l’anidride solforosa, le due sostanze reagiscono per produrre Mg(HSO3)2 e acqua.
- Reazione diretta dell’ossido di magnesio con l’anidride solforosa: ad alte temperature, il gas dell’anidride solforosa reagisce direttamente con l’ossido di magnesio per produrre Mg(HSO3)2 e ossigeno.
- Reazione del solfato di magnesio con l’anidride solforosa: in presenza di un agente riducente, il solfato di magnesio reagisce con l’anidride solforosa gassosa, provocando la produzione di Mg(HSO3)2.
- Carbonato di magnesio con anidride solforosa: la reazione tra carbonato di magnesio e anidride solforosa produce Mg(HSO3)2 e anidride carbonica.
- Reazione dell’ossido di magnesio con acido solforico e anidride solforosa: Quando si fa reagire l’ossido di magnesio con acido solforico e anidride solforosa gassosa, la reazione produce Mg(HSO3)2 e acqua.
Usi del bisolfito di magnesio
Mg(HSO3)2 ha vari usi in diversi settori. Ecco alcune applicazioni comuni:
- Industria alimentare e delle bevande: utilizzato come conservante nell’industria alimentare e delle bevande per prevenire l’ossidazione e la crescita microbica. È comunemente usato nei succhi di frutta, nel vino e nella birra.
- Trattamento dell’acqua: utilizzato nel trattamento dell’acqua come agente riducente per rimuovere il cloro e altri agenti ossidanti. È efficace nel controllare l’odore e il sapore dell’acqua.
- Industria tessile: utilizzato come agente sbiancante nell’industria tessile. È efficace nel rimuovere le macchie e nel migliorare il colore dei tessuti.
- Industria farmaceutica: utilizzato come agente riducente nell’industria farmaceutica. Viene utilizzato per convertire i gruppi nitro in gruppi amminici in varie molecole di farmaci.
- Industria della pasta di legno e della carta: utilizzato nell’industria della pasta di legno e della carta come agente sbiancante. È efficace nel rimuovere la lignina dalla pasta di legno e nel migliorare la lucentezza della carta.
- Agricoltura: utilizzato in agricoltura come ammendante per correggere le carenze di magnesio nel terreno. Viene anche utilizzato come fertilizzante fogliare per migliorare la crescita e la resa delle piante.
Domande:
D: Quali sono le proprietà termodinamiche del bisolfito di magnesio?
R: Le proprietà termodinamiche di Mg(HSO3)2 includono il punto di ebollizione di 250°C, il punto di fusione di 70-72°C e la densità di 1,84 g/mL.
D: Qual è la formula chimica del bisolfito di magnesio?
R: La formula chimica del bisolfito di magnesio è Mg(HSO3)2.
D: Dove posso acquistare il bisolfito di magnesio?
R: Mg(HSO3)2 può essere acquistato da vari fornitori e distributori di prodotti chimici. È comunemente disponibile in grandi e piccole quantità. Alcune piattaforme online come Sigma Aldrich, Fisher Scientific e VWR International offrono anche l’acquisto di Mg(HSO3)2. È importante garantire che il fornitore sia affidabile e che il prodotto soddisfi gli standard richiesti per l’applicazione prevista.
