Il bisolfito di calcio (Ca(HSO3)2) è un composto composto da calcio, zolfo e ossigeno. È comunemente usato come conservante alimentare e antiossidante nell’industria alimentare.
| Nome IUPAC | Idrogenosolfito di calcio |
| Formula molecolare | Ca(HSO3)2 |
| numero CAS | 13780-03-5 |
| Sinonimi | Bisolfito di calcio, Bisolfito di calcio, Acido solforoso di calcio, Bisolfito di calce |
| InChI | InChI=1S/Ca.2H2O3S/c;2*1-4(2)3/h;(H2,1,2,3)/q+2;;/p-2 |
Proprietà del bisolfito di calcio
Formula del bisolfito di calcio
La formula chimica del bisolfito di calcio è Ca(HSO3)2. Indica il numero e il tipo di atomi in una molecola o in un’unità formula. La formula è importante per determinare il peso molecolare, la massa molare e altre proprietà del composto. Ca(HSO3)2 è un composto importante utilizzato nell’industria alimentare come conservante e antiossidante.
Massa molare del bisolfito di calcio
Ca(HSO3)2 ha una massa molare di 202,2 g/mol. È un composto ionico composto da calcio, idrogeno solforato e anidride solforosa. La massa molare è importante per calcolare la quantità di Ca(HSO3)2 necessaria in una reazione o per preparare una soluzione alla concentrazione desiderata.
Punto di ebollizione del bisolfito di calcio
Il punto di ebollizione del Ca(HSO3)2 non è un valore ben definito perché si decompone prima di raggiungere il punto di ebollizione. Ca(HSO3)2 si decompone liberando anidride solforosa. Pertanto, non viene utilizzato in processi che richiedono applicazioni ad alta temperatura.
Bisolfito di calcio Punto di fusione
Il punto di fusione del Ca(HSO3)2 è 203°C. A questa temperatura si decompone formando solfato di calcio e anidride solforosa. La decomposizione di Ca(HSO3)2 è una reazione esotermica e produce una grande quantità di calore. Deve quindi essere maneggiato con cura quando riscaldato.
Densità del bisolfito di calcio g/mL
La densità di Ca(HSO3)2 varia a seconda della forma in cui si trova. La forma anidra di Ca(HSO3)2 ha una densità di 2,68 g/mL, mentre la forma diidrata ha una densità di 1,98 g/mL. La densità di una sostanza è importante per determinare la quantità di sostanza necessaria per riempire un determinato volume.
Peso molecolare del bisolfito di calcio
Il peso molecolare di Ca(HSO3)2 è 202,2 g/mol. Si calcola sommando i pesi atomici degli elementi costitutivi: calcio (40,08 g/mol), idrogeno (1,008 g/mol), zolfo (32,06 g/mol) e ossigeno (15,99 g/mol). Il peso molecolare è importante per determinare la quantità di sostanza necessaria per una reazione.
Struttura del bisolfito di calcio
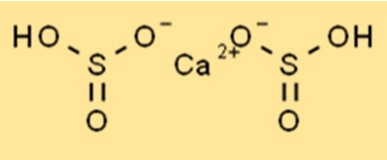
La struttura di Ca(HSO3)2 è un composto ionico con la formula chimica Ca(HSO3)2. Ha una forma tetraedrica con un atomo di calcio centrale circondato da quattro atomi di ossigeno. Gli ioni idrogeno solforato sono legati all’atomo di calcio tramite legami ionici. La struttura del Ca(HSO3)2 è importante per comprenderne le proprietà chimiche.
Solubilità del bisolfito di calcio
Ca(HSO3)2 è moderatamente solubile in acqua, con una solubilità di circa 60 grammi per 100 ml di acqua a temperatura ambiente. La sua solubilità aumenta con la temperatura ed è solubile anche in etanolo e glicerolo.
| Aspetto | Polvere cristallina bianca |
| Peso specifico | 2,68 (anidro), 1,98 (diidrato) |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 202,2 g/mole |
| Densità | 2,68 g/ml (anidro), 1,98 g/ml (diidrato) |
| Punto di fusione | 203°C |
| Punto di ebollizione | Decomposto |
| Punto flash | Non applicabile |
| solubilità in acqua | Solubile |
| Solubilità | Solubile in acqua, insolubile nei solventi organici |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | 1.92 |
| pH | 4.5-6.0 |
Sicurezza e pericoli del bisolfito di calcio
Il Ca(HSO3)2 è generalmente considerato sicuro se utilizzato in piccole quantità nei prodotti alimentari. Tuttavia, può essere pericoloso se non gestito correttamente. Se inalato può causare irritazione alla pelle, irritazione agli occhi e problemi respiratori. L’ingestione di grandi quantità può causare disturbi gastrointestinali, inclusi nausea e vomito. Il Ca(HSO3)2 deve essere maneggiato con cura e quando si lavora con esso si devono indossare dispositivi di protezione, come guanti e un respiratore. Deve essere conservato in un luogo fresco e asciutto, lontano da fonti di calore e materiali incompatibili. Le fuoriuscite devono essere pulite immediatamente per evitare l’esposizione alla sostanza.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | Evitare l’inalazione, l’ingestione e il contatto con la pelle e gli occhi. Indossare dispositivi di protezione. |
| Numeri di identificazione delle Nazioni Unite | Non regolato |
| Codice SA | 28321000 |
| Classe di pericolo | Non classificato |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | Bassa tossicità, ma può causare irritazione alla pelle e agli occhi, problemi respiratori e disturbi gastrointestinali se ingerito in grandi quantità. |
Metodi per la sintesi del bisolfito di calcio
Possono essere utilizzati diversi metodi per sintetizzare Ca(HSO3)2.
Un metodo prevede la reazione del biossido di zolfo gassoso con l’idrossido di calcio , producendo Ca(HSO3)2 e acqua.
Il processo prevede la reazione dell’ossido di calcio con l’anidride solforosa gassosa, generando solfito di calcio. Quindi, la reazione del biossido di zolfo gassoso con il solfito di calcio produce Ca(HSO3)2.
La reazione del gas di anidride solforosa con acqua e carbonato di calcio produce Ca(HSO3)2, gas di anidride carbonica e acqua.
Per sintetizzare Ca(HSO3)2 in laboratorio, è possibile aggiungere anidride solforosa gassosa a una soluzione di idrossido di calcio o ossido di calcio fino a raggiungere il pH desiderato. La soluzione risultante conterrà Ca(HSO3)2, che può essere purificato mediante metodi di filtrazione o precipitazione.
Usi del bisolfito di calcio
Ca(HSO3)2 ha diversi usi in vari settori grazie alle sue proprietà uniche. Ecco alcuni degli usi più comuni di Ca(HSO3)2:
- Industria alimentare: utilizzato come conservante alimentare per prevenire la crescita di batteri e altri microrganismi nei prodotti alimentari, in particolare frutta e verdura.
- Trattamento dell’acqua: utilizzato nel trattamento dell’acqua per rimuovere il cloro in eccesso e altri prodotti chimici dall’acqua e per prevenire la crescita di batteri e alghe nei sistemi idrici.
- Industria tessile: utilizzato nell’industria tessile per rimuovere il colorante in eccesso dal tessuto e prevenirne lo sbiadimento durante il processo di tintura.
- Industria della carta: utilizzato nell’industria della carta per sbiancare la pasta e prevenire lo scolorimento dei prodotti di carta.
- Industria chimica: utilizzato nell’industria chimica come agente riducente e come fonte di anidride solforosa.
- Industria farmaceutica: utilizzato nell’industria farmaceutica come antiossidante e conservante in alcuni farmaci.
Domande:
D: L’Autorità europea per la sicurezza alimentare approva il bisolfito di calcio?
R: Sì, l’Autorità europea per la sicurezza alimentare (EFSA) ha approvato l’uso di Ca(HSO3)2 come additivo alimentare. È elencato come conservante alimentare approvato nell’Unione Europea.
D: Qual è la classificazione E del bisolfito di calcio?
R: Il numero E di Ca(HSO3)2 è E227. Il numero E è un codice assegnato agli additivi alimentari dall’Unione Europea.
D: Il bisolfito di calcio è sicuro?
R: Il Ca(HSO3)2 è generalmente considerato sicuro per il consumo in piccole quantità. Tuttavia, può causare irritazione alla pelle e agli occhi, problemi respiratori e disturbi gastrointestinali se ingerito in grandi quantità. È importante maneggiare e conservare correttamente il Ca(HSO3)2 per garantirne la sicurezza.
D: Qual è la solubilità del bisolfito di calcio in acqua?
R: Ca(HSO3)2 è moderatamente solubile in acqua, con una solubilità di circa 60 grammi per 100 ml di acqua a temperatura ambiente.
D: Quali sono le proprietà termodinamiche del bisolfito di calcio?
R: Le proprietà termodinamiche del Ca(HSO3)2 includono un punto di fusione di circa 150°C e un punto di ebollizione di circa 160°C. Anche la sua capacità termica e l’entalpia di formazione sono state studiate in vari studi di ricerca.
