Il metabisolfito di potassio (K2S2O5), noto anche come pirosolfito di potassio, è un conservante comunemente utilizzato nella vinificazione e nella lavorazione degli alimenti. Funziona rilasciando anidride solforosa, che inibisce la crescita di batteri e lieviti, prolungando così la durata di conservazione dei prodotti.
| Nome dell’IUPAC | Pirosolfito di potassio |
| Formula molecolare | K2S2O5 |
| numero CAS | 16731-55-8 |
| Sinonimi | Disolfito di potassio, acido pirosolforoso, sale dipotassico, metabisolfito di potassio |
| InChI | InChI=1S/2K.H2O5S2/c;;1-6(2)7(3,4)5/h;;(H,1,2)(H,3,4,5)/q2*+1; /p-2 |
Proprietà del metabisolfito di potassio
Formula del metabisolfito di potassio
La formula chimica del metabisolfito di potassio è K2S2O5. Ciò significa che ciascuna molecola di metabisolfito di potassio contiene due ioni di potassio, due atomi di zolfo e cinque atomi di ossigeno. La formula è importante per determinare le proprietà chimiche e il comportamento di K2S2O5 in diverse reazioni e processi.
Massa molare del metabisolfito di potassio
K2S2O5 ha una massa molare di 222,31 g/mol. Questo si calcola sommando le masse atomiche dei suoi elementi costitutivi: due atomi di potassio (39,10 g/mol ciascuno), due atomi di zolfo (32,06 g/mol ciascuno) e cinque atomi di ossigeno (16,00 g/mol ciascuno). . La massa molare è importante per determinare la quantità di K2S2O5 necessaria in una particolare reazione o processo.
Punto di ebollizione del metabisolfito di potassio
K2S2O5 non ha un punto di ebollizione definito perché si decompone prima di raggiungere un punto di ebollizione. A temperature elevate, K2S2O5 si decompone per rilasciare anidride solforosa, che è il principio attivo che agisce come conservante.
Metabisolfito di potassio Punto di fusione
K2S2O5 ha un punto di fusione di circa 190°C (374°F). A questa temperatura il composto solido si scioglie e si trasforma in un liquido limpido. Il punto di fusione è importante per determinare le condizioni appropriate di manipolazione e conservazione per K2S2O5.
Densità del metabisolfito di potassio g/mL
La densità di K2S2O5 è di circa 2,34 g/mL. Ciò significa che un dato volume di K2S2O5 peserà 2,34 volte di più dello stesso volume di acqua. La densità è importante per determinare la quantità appropriata di K2S2O5 da utilizzare in un particolare processo.
Peso molecolare del metabisolfito di potassio
Il peso molecolare di K2S2O5 è 222,31 g/mol. Questo si calcola sommando le masse atomiche dei suoi elementi costitutivi: due atomi di potassio, due atomi di zolfo e cinque atomi di ossigeno. Il peso molecolare è importante per determinare la quantità di K2S2O5 necessaria in una particolare reazione o processo.
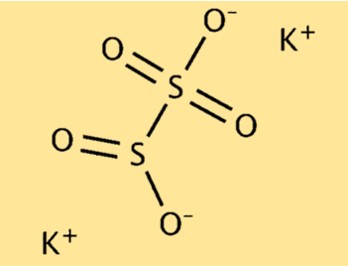
Struttura del metabisolfito di potassio
K2S2O5 ha una struttura molecolare composta da due ioni potassio (K+) e uno ione pirosolfito (S2O5^2-). Lo ione pirosolfito è costituito da due atomi di zolfo e cinque atomi di ossigeno. I due ioni potassio sono attratti dallo ione pirosolfito caricato negativamente, formando un composto ionico stabile.
Solubilità del metabisolfito di potassio
K2S2O5 è solubile in acqua, alcool e glicerolo. La sua solubilità in acqua varia a seconda della temperatura e della concentrazione. A temperatura ambiente è molto solubile in acqua, con una solubilità di circa 70 g/100 mL. Tuttavia, a concentrazioni più elevate può diventare meno solubile e formare precipitati.
| Aspetto | Polvere cristallina bianca o giallo pallido |
| Peso specifico | 2,34 a 20°C |
| Colore | Da bianco a leggermente giallo |
| Odore | Solforoso, piccante |
| Massa molare | 222,31 g/mole |
| Densità | 2,34 g/ml a 25°C |
| Punto di fusione | 190-240°C |
| Punto di ebollizione | Si rompe prima dell’ebollizione |
| Punto flash | Non applicabile (solido) |
| solubilità in acqua | Solubile in acqua |
| Solubilità | Solubile in etanolo e glicerolo, leggermente solubile in etere |
| Pressione del vapore | Trascurabile a temperatura ambiente |
| Densità del vapore | Non applicabile (solido) |
| pKa | 4.34 |
| pH | 4,5-5,5 in soluzione al 10%. |
Sicurezza e pericoli del metabisolfito di potassio
K2S2O5 può comportare rischi per la sicurezza se non maneggiato correttamente. Se inalato può causare irritazione alla pelle, irritazione agli occhi e problemi respiratori. Il contatto diretto con la sostanza può provocare arrossamento, prurito e sensazione di bruciore. Se ingerito può causare anche problemi digestivi. La sostanza può rilasciare gas tossico di anidride solforosa se riscaldata. È quindi necessaria un’adeguata ventilazione durante la movimentazione e lo stoccaggio. È importante indossare dispositivi di protezione individuale adeguati come guanti e occhiali di sicurezza durante la manipolazione di K2S2O5. Anche una corretta conservazione è fondamentale, poiché può reagire con acidi, metalli e altri prodotti chimici.
| Simboli di pericolo | Xi (irritante) |
| Descrizione della sicurezza | Mantenere il contenitore ben chiuso e asciutto; Non ingerire; Indossare indumenti protettivi, guanti e protezioni per gli occhi/il viso adeguati; In caso di contatto con gli occhi, immediatamente abbondantemente con acqua e risciacquare un medico; In caso di ingestione consultare immediatamente il medico e mostrargli il contenitore o l’etichetta. |
| Numeri di identificazione delle Nazioni Unite | ONU 2676 |
| Codice SA | 2832.10.00 |
| Classe di pericolo | 8 – Sostanze corrosive |
| Gruppo di imballaggio | III |
| Tossicità | LD50 (ratto, orale) – 2.000 mg/kg; LC50 (ratto, inalazione) – 17 ppm/4 ore |
Metodi per la sintesi del metabisolfito di potassio
Diversi metodi possono sintetizzare K2S2O5.
Un metodo comune prevede la reazione tra idrossido di potassio e anidride solforosa. Il recipiente di reazione combina le due sostanze chimiche e le riscalda. Il gas risultante passa attraverso l’acqua, producendo solfito di potassio . Il perossido di idrogeno ossida il solfito di potassio, formando solfato di potassio. L’anidride solforosa reagisce con il solfato di potassio per produrre K2S2O5.
Un altro metodo prevede la reazione del carbonato di potassio e dell’anidride solforosa. Il recipiente di reazione mescola le due sostanze chimiche e le riscalda. La miscela produce un gas che passa attraverso una soluzione di solfito di potassio , creando bisolfito di potassio. Il perossido di idrogeno ossida il bisolfito di potassio, formando solfato di potassio. L’anidride solforosa reagisce con il solfato di potassio, producendo K2S2O5.
Usi del metabisolfito di potassio
K2S2O5 ha una vasta gamma di applicazioni in vari settori. Alcuni usi comuni includono:
- Conservazione degli alimenti: utilizzato come conservante alimentare per prevenire il deterioramento e prolungare la durata di conservazione. Comunemente utilizzato nella produzione di vino, birra e succhi di frutta.
- Fotografia: utilizzato in fotografia come sviluppatore e fissatore per pellicole e stampe.
- Industria tessile: utilizzato nell’industria tessile per rimuovere la tintura e lo sbiancamento in eccesso dai tessuti.
- Trattamento dell’acqua: utilizzato come prodotto chimico per il trattamento dell’acqua per rimuovere il cloro e altre impurità.
- Industria farmaceutica: utilizzato nell’industria farmaceutica come antiossidante per prevenire la degradazione del farmaco.
- Estrazione dell’oro: utilizzato nell’estrazione dell’oro per separare l’oro da altri metalli e impurità.
- Produzione chimica: utilizzata nella produzione di vari prodotti chimici come coloranti, resine e plastica.
- Industria della pasta di legno e della carta: utilizzato nell’industria della pasta di legno e della carta per sbiancare i prodotti di carta.
Domande:
D: Quanto metabisolfito di potassio per gallone?
R: La quantità di K2S2O5 necessaria per gallone varia a seconda dell’uso previsto. Per la vinificazione, la quantità consigliata è da 1/16 a 1/4 di cucchiaino per gallone. Per preparare il sidro, la quantità consigliata è 1/4 di cucchiaino per litro. È importante rispettare scrupolosamente il dosaggio consigliato per garantire l’effetto desiderato ed evitare un consumo eccessivo che può essere dannoso.
D: Quando dovrei usare il sorbato di potassio o il metabisolfito di potassio?
R: Il sorbato di potassio e K2S2O5 sono entrambi utilizzati come conservanti nell’industria alimentare e delle bevande. Il sorbato di potassio viene utilizzato per prevenire la crescita di lieviti e muffe, mentre K2S2O5 viene utilizzato per inibire la crescita e l’ossidazione batterica. Il sorbato di potassio viene generalmente utilizzato in prodotti non acidi, come sciroppi e marmellate, mentre K2S2O5 viene utilizzato in prodotti acidi come vino e sidro. La scelta tra i due preservativi dipende dal prodotto specifico e dalle sue esigenze.
D: Dove acquistare il metabisolfito di potassio?
R: K2S2O5 può essere acquistato presso negozi di prodotti chimici, rivenditori online e negozi di birra fatta in casa. È importante garantire che il prodotto sia di alta qualità e destinato all’uso previsto.
D: Quanto metabisolfito di potassio per litro di sidro?
R: La quantità consigliata di K2S2O5 per preparare il sidro è 1/4 di cucchiaino per gallone. Questa quantità viene aggiunta dopo la fermentazione per prevenire l’ossidazione e la crescita batterica e per preservare il sapore e la qualità del sidro.
D: Qual è la differenza tra K2S2O5 e K2S2O8?
R: K2S2O5 e K2S2O8 sono entrambi sali di potassio, ma hanno strutture e proprietà chimiche diverse. K2S2O5 è una polvere cristallina bianca utilizzata come conservante e antiossidante, mentre K2S2O8 è un forte agente ossidante utilizzato in reazioni chimiche come la sintesi organica e il trattamento delle acque reflue. La differenza principale tra i due sono le loro proprietà chimiche e l’uso previsto.
