Il metabisolfito di sodio (Na2S2O5) è un composto chimico utilizzato come conservante e antiossidante negli alimenti e nelle bevande. Può anche essere utilizzato come disinfettante e sbiancante in vari settori.
| Nome IUPAC | Pirosolfito di sodio |
| Formula molecolare | Na2S2O5 |
| numero CAS | 7681-57-4 |
| Sinonimi | Disolfito disodico, acido pirosolforoso, sale bisodico, pirosolfito di sodio, disolfito di sodio |
| InChI | InChI=1S/2Na.H2O5S2/c;;1-6(2)7(3,4)5/h;;(H,1,2)(H,3,4,5)/q2*+1; /p-2 |
Proprietà del metabisolfito di sodio
Formula del metabisolfito di sodio
La formula chimica del metabisolfito di sodio è Na2S2O5. È composto da due ioni sodio (Na+) e uno ione disolfito (S2O5-2). Il composto è una polvere cristallina bianca o giallastra, solubile in acqua ed emettente un odore pungente.
Massa molare del metabisolfito di sodio
La massa molare di Na2S2O5 è 190,107 g/mol. Questo valore si calcola sommando le masse atomiche degli elementi presenti nel composto, che sono 22,99 g/mol per il sodio, 32,06 g/mol per lo zolfo e 15,99 g/mol per l’ossigeno. La massa molare è una proprietà importante che aiuta a determinare la quantità di sostanza necessaria per una reazione chimica.
Punto di ebollizione del metabisolfito di sodio
Na2S2O5 ha un punto di fusione elevato di 150°C, ma si decompone prima di poter bollire. Il composto si decompone in anidride solforosa (SO2) e solfito di sodio (Na2SO3) ad una temperatura di circa 150°C. Pertanto, il punto di ebollizione di Na2S2O5 non è applicabile.
Metabisolfito di sodio Punto di fusione
Il punto di fusione di Na2S2O5 è 150°C. A questa temperatura il composto subisce un cambiamento di fase da solido a liquido. Il punto di fusione è un’importante proprietà fisica che aiuta a identificare e caratterizzare una sostanza.
Densità del metabisolfito di sodio g/mL
La densità di Na2S2O5 è 1,48 g/mL. È un composto relativamente denso che affonda nell’acqua. La densità di una sostanza è la massa per unità di volume ed è un’importante proprietà fisica che aiuta a determinare la quantità di sostanza contenuta in un dato volume.
Peso molecolare del metabisolfito di sodio
Il peso molecolare di Na2S2O5 è 190,107 g/mol. È la somma dei pesi atomici di tutti gli atomi presenti nel composto. Il peso molecolare è una proprietà importante che aiuta a calcolare la quantità di una sostanza necessaria per una reazione chimica.
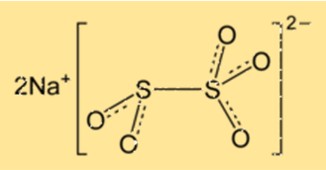
Struttura del metabisolfito di sodio
Na2S2O5 ha una struttura cristallina e appartiene al sistema cristallino ortorombico. Il reticolo cristallino è composto da ioni sodio e ioni disolfito disposti secondo uno schema ripetuto. Il composto ha una geometria molecolare tetraedrica, con gli atomi di zolfo al centro del tetraedro.
Solubilità del metabisolfito di sodio
Na2S2O5 è altamente solubile in acqua, con una solubilità di 54 g/100 mL a 25°C. È anche solubile in glicerolo e leggermente solubile in etanolo. La solubilità di una sostanza è una proprietà importante che determina la sua capacità di dissolversi in un dato solvente.
| Aspetto | Polvere cristallina bianca o giallastra |
| Peso specifico | 1.48 |
| Colore | Da bianco a giallastro |
| Odore | Acri |
| Massa molare | 190,107 g/mole |
| Densità | 1,48 g/ml |
| Punto di fusione | 150°C |
| Punto di ebollizione | Si rompe prima dell’ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | 54 g/100 ml a 25°C |
| Solubilità | Solubile in glicerolo e leggermente solubile in etanolo |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | 7.2 |
| pH | 4,5 (soluzione al 5%) |
Sicurezza e pericoli del metabisolfito di sodio
Na2S2O5 può essere pericoloso se non maneggiato correttamente. È un forte agente riducente che può causare irritazione alla pelle, agli occhi e al sistema respiratorio in caso di esposizione. L’ingestione del composto può causare gravi disturbi gastrointestinali. Na2S2O5 deve essere conservato in un’area fresca, asciutta e ben ventilata, lontano da materiali incompatibili. Non deve essere miscelato con acidi forti, forti ossidanti o agenti riducenti. Durante la manipolazione del composto è necessario utilizzare dispositivi di protezione come guanti, occhiali e respiratori. Le misure di emergenza, come stazioni per il lavaggio degli occhi ed estintori, dovrebbero essere prontamente disponibili in caso di incidente.
| Simboli di pericolo | Xi (irritante) |
| Descrizione della sicurezza | Evitare il contatto con la pelle e gli occhi. Indossare indumenti e guanti protettivi. Non ingerire. Utilizzare con ventilazione adeguata. |
| Numeri di identificazione delle Nazioni Unite | ONU 2676 |
| Codice SA | 2832.10.00 |
| Classe di pericolo | 8 (Sostanze corrosive) |
| Gruppo di imballaggio | III |
| Tossicità | LD50 (orale, ratto): 1.000 mg/kg; LC50 (inalazione, ratto): 11 mg/L (4 ore) |
Metodi per la sintesi del metabisolfito di sodio
Na2S2O5 può essere sintetizzato con vari metodi, inclusa la reazione del bisolfito di sodio con l’anidride solforosa in presenza di un agente ossidante come il perossido di idrogeno . Il processo riscalda l’addotto di bisolfito di sodio e anidride solforosa per formare Na2S2O5.
Un altro metodo prevede la reazione dell’idrossido di sodio con il biossido di zolfo gassoso, seguita dall’aggiunta di acido solforico per formare solfato di sodio e Na2S2O5.
Un altro metodo di sintesi prevede la reazione del carbonato di sodio con l’anidride solforosa e quindi il riscaldamento del solfito di sodio risultante in presenza di aria. Questo processo produce solfato di sodio e Na2S2O5.
In presenza di un agente ossidante come il perossido di idrogeno o l’acido nitrico, Na2S2O5 può essere preparato facendo reagire lo zolfo con il solfito di sodio.
Nell’industria, il metodo più comune per sintetizzare Na2S2O5 è quello di far reagire il bisolfito di sodio con l’anidride solforosa in presenza di un catalizzatore come il biossido di manganese. Il riscaldamento dell’addotto bisolfito di sodio/anidride solforosa forma Na2S2O5.
Usi del metabisolfito di sodio
Na2S2O5 ha vari usi in diversi settori grazie alle sue forti proprietà riducenti e alla sua capacità di agire come conservante e antiossidante. Alcuni degli usi comuni di Na2S2O5 includono:
- Industria alimentare e delle bevande: ampiamente utilizzato come conservante e antiossidante in prodotti alimentari e bevande come vino, birra, succhi di frutta e frutta secca. Ciò aiuta a prevenire il deterioramento e l’ossidazione di questi prodotti, prolungandone così la durata.
- Industria farmaceutica: utilizzato come antiossidante in vari prodotti farmaceutici come creme, unguenti e compresse. Aiuta a prevenire il degrado di questi prodotti a causa dell’esposizione all’aria e alla luce.
- Trattamento dell’acqua: utilizzato per declorare l’acqua negli impianti di trattamento dell’acqua. Aiuta ad eliminare l’eccesso di cloro e clorammine, che possono essere dannosi per la vita acquatica.
- Fotografia: utilizzato come sviluppatore e fissatore fotografico nel settore della fotografia. Aiuta a ridurre gli ioni d’argento in argento metallico, formando così l’immagine fotografica.
- Industria tessile: utilizzato come agente riducente nell’industria tessile per i processi di tintura e stampa. Aiuta a rimuovere l’ossigeno in eccesso dalla soluzione colorante, migliorando l’intensità e l’uniformità del colore.
Domande:
D: Dove posso acquistare localmente il metabisolfito di sodio?
R: Na2S2O5 si trova solitamente nei negozi di prodotti chimici o nei rivenditori online. Potrebbe anche essere disponibile in alcuni negozi di specialità alimentari, poiché è comunemente usato come conservante nell’industria alimentare.
D: Dove acquistare il metabisolfito di sodio?
R: Na2S2O5 può essere acquistato presso negozi di prodotti chimici o rivenditori online di prodotti chimici specializzati. Potrebbe anche essere disponibile in alcuni negozi di specialità alimentari.
D: Il metabisolfito di sodio è sicuro?
R: Na2S2O5 può essere pericoloso se non maneggiato correttamente. È importante indossare dispositivi di protezione adeguati e seguire le precauzioni di sicurezza durante la manipolazione di questo composto. Può causare irritazione alla pelle e agli occhi e può anche rilasciare anidride solforosa tossica se miscelato con acido. Tuttavia, se utilizzato a concentrazioni adeguate e maneggiato con cura, Na2S2O5 è generalmente considerato sicuro per gli usi previsti.
D: È possibile trasformare il bisolfato di sodio in metabisolfito di sodio?
R: Sì, il bisolfato di sodio (NaHSO4) può essere convertito in Na2S2O5 riscaldandolo ad alta temperatura in presenza di un agente ossidante, come il perossido di idrogeno. La reazione provoca il rilascio di acqua e la formazione di Na2S2O5.
D: Qual è la differenza tra bisolfito di sodio e metabisolfito di sodio?
R: La principale differenza tra NaHSO3 e Na2S2O5 è la loro struttura chimica. Il bisolfito di sodio ha un gruppo solfito (-SO3) e uno ione idrogeno (H+), mentre Na2S2O5 ha due gruppi solfito (-SO3) legati insieme. Na2S2O5 è anche più stabile e ha una durata di conservazione più lunga rispetto al bisolfito di sodio.
D: Qual è il numero di ossidazione di S in Na2S2O5?
R: Il numero di ossidazione dello zolfo (S) in Na2S2O5 è +5.
D: Come trovare una concentrazione di IO3- da KIO3 e Na2S2O5?
R: La concentrazione di IO3- può essere determinata mediante titolazione con una concentrazione nota di tiosolfato di sodio (Na2S2O3), utilizzando l’amido come indicatore. La reazione tra KIO3 e Na2S2O5 produce iodio (I2), che reagisce con Na2S2O3 per formare NaI e Na2S4O6. Misurando il volume di Na2S2O3 necessario per reagire con lo iodio, è possibile calcolare la concentrazione di IO3-.
D: Quali ioni contiene Na2S2O5?
R: Na2S2O5 è composto da due ioni sodio (Na+) e uno ione disolfito (-S2O5).
