Il solfito di potassio (K2SO3) è un composto chimico composto da potassio, zolfo e ossigeno. È comunemente usato come conservante nell’industria alimentare per prevenire scolorimento e deterioramento.
| Nome IUPAC | Solfito di potassio |
| Formula molecolare | K2SO3 |
| numero CAS | 10117-38-1 |
| Sinonimi | Solfito dipotassico; Sale dipotassico dell’acido solforoso; Solfonato di potassio; Ossido di zolfo e potassio |
| InChI | InChI=1S/2K.H2O3S/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
Solfito di potassio
Formula di solfito di potassio
Il solfito di potassio ha la formula chimica K2SO3, che indica che contiene due atomi di potassio, un atomo di zolfo e tre atomi di ossigeno. Il composto si forma dalla reazione tra idrossido di potassio (KOH) e anidride solforosa (SO2). Il solfito di potassio è un composto ionico, il che significa che è composto da ioni di potassio caricati positivamente e ioni solfito caricati negativamente. La formula dello ione solfito è SO32-.
Massa molare del solfito di potassio
La massa molare di K2SO3 è 158,26 g/mol. Questo si calcola sommando le masse atomiche di ciascun elemento nella formula (2 x massa atomica di K) + massa atomica di S + (3 x massa atomica di O). La massa molare di un composto è importante perché aiuta a calcolare la quantità di composto necessaria per una determinata reazione o a determinare la concentrazione di una soluzione.
Punto di ebollizione del solfito di potassio
K2SO3 non ha un punto di ebollizione specifico perché si decompone prima di raggiungere il punto di ebollizione. Tuttavia, quando riscaldato, K2SO3 subisce una decomposizione termica per formare solfato di potassio (K2SO4) e anidride solforosa (SO2). La temperatura di decomposizione è di circa 390°C.
Punto di fusione del solfito di potassio
Il punto di fusione di K2SO3 è intorno ai 350°C. A questa temperatura il composto solido si trasforma in liquido. Tuttavia, all’aumentare della temperatura, K2SO3 si decompone, come accennato in precedenza.
Densità del solfito di potassio g/mL
La densità di K2SO3 è 2,44 g/mL a temperatura ambiente. La densità è definita come la massa di una sostanza per unità di volume. L’elevata densità di K2SO3 indica che si tratta di un composto relativamente pesante. Questa proprietà è importante per determinare le proprietà fisiche del composto, come la sua solubilità e reattività.
Peso molecolare del solfito di potassio
Il peso molecolare di K2SO3 è 158,26 g/mol. Questo valore rappresenta la massa media di una molecola del composto. Il peso molecolare è importante per calcolare la quantità di una sostanza in un dato volume o massa, utile nelle reazioni chimiche e negli esperimenti di laboratorio.
Struttura del solfito di potassio
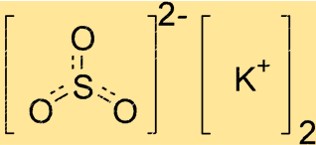
K2SO3 ha una struttura cristallina, il che significa che i suoi atomi sono disposti secondo uno schema ripetuto. Il composto ha una geometria planare trigonale, con l’atomo di zolfo al centro e i tre atomi di ossigeno disposti simmetricamente attorno ad esso. Gli ioni potassio si trovano all’esterno di questa struttura, bilanciando la carica negativa degli ioni solfito.
Solubilità del solfito di potassio
K2SO3 è altamente solubile in acqua. A temperatura ambiente può dissolversi in acqua formando una soluzione limpida e incolore. La solubilità di K2SO3 è dovuta alla sua natura ionica, che gli consente di dissociarsi nei suoi ioni costituenti in acqua. La solubilità di K2SO3 è influenzata anche dalla temperatura, la cui solubilità aumenta all’aumentare della temperatura.
| Aspetto | Polvere cristallina bianca |
| Peso specifico | 2.44 |
| Colore | Incolore |
| Odore | Inodore |
| Massa molare | 158,26 g/mole |
| Densità | 2,44 g/ml |
| Punto di fusione | 350°C |
| Punto di ebollizione | Si decompone a 390°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile in acqua |
| Solubilità | Solubile in etanolo e glicerolo |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | 10.3 (per acido solforoso) |
| pH | ~9 (per una soluzione 0,1 M) |
Sicurezza e pericoli del solfito di potassio
K2SO3 è relativamente sicuro da maneggiare e utilizzare se vengono prese le dovute precauzioni. Tuttavia, può rappresentare un pericolo se non maneggiato con attenzione. Il composto può causare irritazione alla pelle, agli occhi e al sistema respiratorio se entra in contatto con queste parti del corpo. K2SO3 può anche causare problemi gastrointestinali se ingerito. Inoltre, il composto presenta un potenziale pericolo di incendio ed esplosione se esposto a calore o fiamme. Pertanto, è necessario adottare misure di sicurezza adeguate quando si lavora con K2SO3, come indossare dispositivi di protezione e conservare il composto lontano da fonti di calore e fonti di ignizione.
| Simboli di pericolo | Teschio e ossa incrociate |
| Descrizione della sicurezza | Tossico, nocivo per ingestione, irritante per la pelle e gli occhi |
| Numeri di identificazione delle Nazioni Unite | ONU 2697 |
| Codice SA | 283210 |
| Classe di pericolo | 6.1 (Sostanze tossiche) |
| Gruppo di imballaggio | II (Pericolo medio) |
| Tossicità | Orale (LD50): 345 mg/kg (ratto) |
Metodi di sintesi del solfito di potassio
K2SO3 può essere sintetizzato con diversi metodi, tra cui la reazione dell’idrossido di potassio con anidride solforosa o zolfo, la reazione del carbonato di potassio con anidride solforosa e la reazione del bisolfito di potassio con idrossido. potassio.
Nel primo metodo, una soluzione di idrossido di potassio reagisce con il biossido di zolfo gassoso in presenza di acqua per formare K2SO3. Nel secondo metodo, una miscela di carbonato di potassio e anidride solforosa viene riscaldata ad alte temperature per produrre K2SO3. Il terzo metodo prevede la miscelazione del bisolfito di potassio con l’idrossido di potassio per produrre K2SO3 e acqua.
Un altro metodo comune per sintetizzare K2SO3 è la reazione dell’anidride solforosa con un sale di potassio, come il cloruro di potassio, in presenza di agenti riducenti come l’idrosolfito di sodio o il solfato di ferro (II). Questo metodo viene spesso utilizzato in ambienti industriali per produrre grandi quantità di K2SO3.
Usi del solfito di potassio
K2SO3 ha diverse applicazioni in diversi settori grazie alle sue proprietà chimiche. Ecco alcuni usi comuni di K2SO3:
- Industria alimentare e delle bevande: utilizzato come conservante alimentare per prevenire il deterioramento e lo scolorimento di alimenti come vino, frutta secca e gamberetti.
- Fotografia: utilizzato come agente fissativo fotografico per impedire l’ulteriore sviluppo della pellicola e rendere l’immagine permanente.
- Trattamento dell’acqua: utilizzato come agente riducente per rimuovere il cloro dall’acqua e per trattare le acque reflue.
- Industria della carta: utilizzato come agente sbiancante per rimuovere le impurità e sbiancare la pasta nel processo di fabbricazione della carta.
- Industria tessile: utilizzato come agente riducente per rimuovere il colorante in eccesso dai tessuti e per sbiancare i tessuti.
- Industria chimica: utilizzato come agente riducente nelle reazioni chimiche per convertire gli agenti ossidanti in agenti riducenti.
- Industria medicinale: utilizzato in alcuni trattamenti medici per prevenire o alleviare i sintomi di determinate condizioni.
Domande:
D: Qual è la formula del solfito di potassio?
R: La formula del solfito di potassio è K2SO3.
D: Il solfato di potassio è un solfito?
R: No, il solfato di potassio non è un solfito. È un sale composto da potassio, zolfo e ossigeno con la formula chimica K2SO4.
D: Quale sale viene prodotto quando H2SO4 reagisce con NaOH? K2SO3, Na2SO4, Na2SO3, K2SO4
R: Quando H2SO4 reagisce con NaOH, il sale prodotto è Na2SO4.
D: Quanti ioni SO32 sono contenuti in 99,6 mg di Na2SO3?
La massa molare di Na2SO3 è 126,05 g/mol. R: Per calcolare il numero di ioni SO32-, dobbiamo prima trovare il numero di moli di Na2SO3: 99,6 mg / 126,05 g/mol = 0,000789 mol. Poiché Na2SO3 contiene due ioni SO32- per molecola, il numero di ioni SO32- in 0,000789 mol di Na2SO3 è 0,000789 mol x 2 = 0,00158 mol. Pertanto, ci sono 0,00158 mol x 6,022 x 10^23 ioni/mol = 9,52 x 10^20 ioni SO32- in 99,6 mg di Na2SO3.
D: Quanti ioni sodio ci sono in 99,6 mg di Na2SO3? La massa molare di Na2SO3 è 126,05 g/mol.
R: Per calcolare il numero di ioni sodio, dobbiamo prima trovare il numero di moli di Na2SO3: 99,6 mg / 126,05 g/mol = 0,000789 mol. Poiché ciascuna molecola di Na2SO3 contiene due ioni sodio, il numero di ioni sodio in 0,000789 moli di Na2SO3 è 0,000789 mol x 2 = 0,00158 mol. Pertanto, ci sono 0,00158 mol x 6,022 x 10^23 ioni/mol = 9,52 x 10^20 ioni sodio in 99,6 mg di Na2SO3.
D: Qual è il nome chimico di Na2SO3?
R: Il nome chimico di Na2SO3 è solfito di sodio.
D: Qual è il nome del composto con la formula Na2SO3?
R: Il nome del composto con la formula Na2SO3 è solfito di sodio.
