Il solfito di sodio, noto anche come Na2SO3, è una polvere cristallina bianca comunemente utilizzata come conservante nell’industria alimentare e come agente riducente in fotografia.
| Nome IUPAC | Solfito disodico |
| Formula molecolare | Na2SO3 |
| numero CAS | 7757-83-7 |
| Sinonimi | Solfito di sodio; Solfito disodico; Acido solforoso, sale bisodico; Solfonato di sodio; Solfito di sodio |
| InChI | InChI=1S/2Na.H2O3S/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
Proprietà del solfito di sodio
Formula di solfito di sodio
La formula chimica del solfito di sodio è Na2SO3. È composto da due ioni Na+ e uno ione SO32-. Gli ioni Na+ trasportano una carica positiva mentre lo ione SO32- trasporta una carica negativa. Il solfito di sodio è un composto ionico che forma una polvere cristallina bianca.
Massa molare del solfito di sodio
La massa molare di Na2SO3 è 126,04 g/mol. Questo valore si ottiene sommando le masse atomiche di ciascun elemento presente nel composto. Le masse atomiche di sodio, zolfo e ossigeno sono rispettivamente 22,99 g/mol, 32,06 g/mol e 15,99 g/mol. La massa molare è un parametro importante utilizzato nei calcoli stechiometrici e può essere utilizzato anche per determinare la quantità di sostanza presente in un campione.
Punto di ebollizione del solfito di sodio
Na2SO3 ha un punto di ebollizione relativamente alto di 1650°C. Ciò è dovuto ai forti legami ionici tra gli ioni Na+ e SO32-, che richiedono una grande quantità di energia per rompersi. Il punto di ebollizione è la temperatura alla quale una sostanza passa dalla fase liquida a quella gassosa. A questa temperatura, la pressione del vapore del liquido è uguale alla pressione atmosferica.
Punto di fusione del solfito di sodio
Il punto di fusione di Na2SO3 è 33,4°C. Questo punto di fusione relativamente basso è dovuto alle deboli forze intermolecolari tra le molecole di Na2SO3. Quando riscaldato, le forze intermolecolari vengono superate e il Na2SO3 solido si scioglie in un liquido.
Densità del solfito di sodio g/mL
La densità di Na2SO3 è 2,633 g/mL. La densità è definita come la massa di una sostanza per unità di volume. L’elevata densità di Na2SO3 è dovuta alla sua natura ionica e alla presenza di due ioni sodio per ione solfito nella sua struttura.
Peso molecolare del solfito di sodio
Il peso molecolare di Na2SO3 è 126,04 g/mol. Questo valore si ottiene sommando i pesi atomici di ciascun elemento presente nel composto. Il peso molecolare è un parametro importante utilizzato nei calcoli stechiometrici e può essere utilizzato anche per determinare la quantità di sostanza presente in un campione.
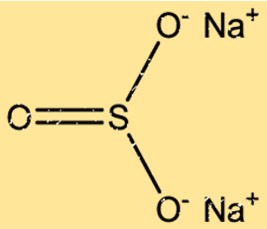
Struttura del solfito di sodio
Na2SO3 ha una struttura cristallina con due ioni Na+ e uno ione SO32- disposti in uno schema ripetuto. Gli ioni Na+ sono disposti in un reticolo cubico a facce centrate, mentre gli ioni SO32- occupano i siti ottaedrici del reticolo. I legami ionici tra gli ioni Na+ e SO32- danno luogo ad una struttura cristallina stabile.
Solubilità del solfito di sodio
Na2SO3 è altamente solubile in acqua, con una solubilità di 22,4 g/100 mL a 20°C. Questa elevata solubilità è dovuta alla natura ionica di Na2SO3, che gli consente di dissociarsi in acqua e formare ioni Na+ e SO32-. La solubilità di Na2SO3 in acqua aumenta con la temperatura, poiché l’energia cinetica delle molecole aumenta e nella soluzione vengono rilasciati più ioni.
| Aspetto | Polvere cristallina bianca |
| Peso specifico | 2.633 g/cm³ |
| Colore | Da incolore a bianco |
| Odore | Inodore |
| Massa molare | 126,04 g/mole |
| Densità | 2.633 g/ml |
| Punto di fusione | 33,4°C |
| Punto di ebollizione | 1650°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile |
| Solubilità | Solubile in glicerolo, leggermente solubile in etanolo |
| Pressione del vapore | 0 mmHg a 20°C |
| Densità del vapore | Non applicabile |
| pKa | 6:35 |
| pH | 8,3 – 9,5 (soluzione al 5%) |
Sicurezza e pericoli del solfito di sodio
Na2SO3 può essere pericoloso se non maneggiato correttamente. Può causare irritazione alla pelle e agli occhi e, se ingerito, può provocare nausea, vomito e dolore addominale. Può anche causare irritazione alle vie respiratorie se inalato. Inoltre, Na2SO3 può reagire con altre sostanze chimiche per produrre gas tossici, come il biossido di zolfo, che può essere dannoso per la salute. È quindi importante indossare adeguati dispositivi di protezione individuale durante la manipolazione di Na2SO3 ed evitare l’esposizione degli occhi, della pelle e delle mucose. Na2SO3 deve inoltre essere conservato in un’area fresca, asciutta e ben ventilata, lontano da materiali incompatibili.
| Simboli di pericolo | Xi,O |
| Descrizione della sicurezza | Evitare il contatto con la pelle e gli occhi. In caso di contatto sciacquare immediatamente e abbondantemente con acqua e consultare un medico. Non ingerire. Evitare l’inalazione di polvere. Indossare adeguati dispositivi di protezione individuale. Tenere lontano da fonti di calore, scintille e fiamme. |
| UN ID | 1384 |
| Codice SA | 283210 |
| Classe di pericolo | 8 – Sostanze corrosive |
| Gruppo di imballaggio | III |
| Tossicità | LD50 (orale, ratto) – 1.640 mg/kg; LC50 (inalazione, ratto) – 63 mg/m³ |
Metodi per la sintesi del solfito di sodio
Vari metodi possono sintetizzare Na2SO3.
Un metodo comune consiste nel far reagire l’idrossido di sodio con il biossido di zolfo gassoso in presenza di acqua. La reazione produce Na2SO3 e acqua come sottoprodotti.
In un altro metodo, il carbonato di sodio reagisce con il biossido di zolfo in presenza di acqua, producendo Na2SO3 e biossido di carbonio. Per aumentare la resa di Na2SO3, questa reazione può essere effettuata a temperature e pressioni elevate.
La reazione del bisolfito di sodio con l’idrossido di sodio può sintetizzare Na2SO3. Questa reazione produce Na2SO3, acqua e cloruro di sodio come sottoprodotti.
Un altro metodo prevede la reazione del solfuro di sodio con il biossido di zolfo gassoso in presenza di acqua per produrre Na2SO3 e gas di idrogeno solforato.
Per sintetizzare Na2SO3, il solfato di sodio deve essere trattato con anidride solforosa in presenza di un agente riducente, come il carbone attivo. Questa reazione produce Na2SO3 e anidride carbonica.
Ciascuno di questi metodi presenta vantaggi e svantaggi e la scelta del metodo dipende da vari fattori, come la resa desiderata, la purezza e il costo del prodotto e la disponibilità di reagenti e attrezzature.
Usi del solfito di sodio
Na2SO3 ha diversi importanti usi industriali e commerciali, tra cui:
- Fotografia: utilizzato come agente riducente e conservante nelle soluzioni di sviluppo fotografico. Ciò aiuta a stabilizzare l’immagine e a prevenire lo sbiadimento.
- Trattamento dell’acqua: utilizzato per rimuovere il cloro e l’ossigeno in eccesso dall’acqua negli impianti di trattamento delle acque industriali e comunali. Aiuta anche a prevenire la corrosione di tubi e apparecchiature.
- Industria della carta e della pasta di legno: utilizzato nella produzione di carta e pasta di legno per sbiancare e ridurre il contenuto di lignina della pasta. Ciò aiuta a migliorare la qualità e il colore della carta.
- Industria alimentare: utilizzato come conservante e antiossidante nell’industria alimentare. Aiuta a prevenire lo scolorimento e il deterioramento degli alimenti, come frutta secca, vino e birra.
- Industria tessile: utilizzato come agente riducente e agente sbiancante nell’industria tessile per rimuovere il colorante in eccesso e migliorare la solidità del colore dei tessuti.
- Industria chimica: utilizzato come agente riducente in varie reazioni chimiche, come nella produzione di coloranti, prodotti farmaceutici e polimeri.
- Altri usi: utilizzato anche nella produzione di detersivi, prodotti in pelle e prodotti per la cura personale, come tinture per capelli e shampoo.
Domande:
D: Cos’è il normale solfito di sodio in una caldaia?
R: La concentrazione normale di Na2SO3 in una caldaia è generalmente compresa tra 20 e 40 parti per milione (ppm), a seconda della pressione operativa e di altri fattori.
D: Come si bilancia l’anidride solforosa con l’idrossido di sodio per formare solfito di sodio e acqua?
R: Per bilanciare l’equazione per la reazione del biossido di zolfo e dell’idrossido di sodio per formare Na2SO3 e acqua, è necessario assicurarsi che ci sia un numero uguale di atomi di ciascun elemento nei due lati dell’equazione. L’equazione bilanciata sarebbe SO2 + 2NaOH → Na2SO3 + H2O.
D: Cos’è il solfito di sodio?
R: Na2SO3 è un composto cristallino bianco comunemente utilizzato in varie applicazioni industriali e commerciali, come la fotografia, il trattamento delle acque, la produzione di carta e la conservazione degli alimenti.
D: Qual è la formula del solfito di sodio?
R: La formula del solfito di sodio è Na2SO3.
D: È a base di solfito di sodio?
R: Na2SO3 è un sale di una base forte (idrossido di sodio) e di un acido debole (acido solforoso) e quindi ha proprietà basiche. Tuttavia, non è generalmente considerata una base solida.
D: Il solfito di sodio è stabile in acqua?
R: Na2SO3 è relativamente stabile in acqua, ma può decomporsi gradualmente nel tempo, soprattutto in presenza di ossigeno o altri agenti ossidanti.
D: Il solfito di sodio è infiammabile?
R: Na2SO3 non è infiammabile, ma può reagire con alcuni agenti ossidanti per rilasciare anidride solforosa, che è irritante per le vie respiratorie e può essere infiammabile.
D: Dove acquistare localmente il solfito di sodio?
R: Na2SO3 può essere acquistato da società di fornitura di prodotti chimici, fornitori industriali e alcuni rivenditori specializzati. Potrebbe anche essere disponibile presso alcuni negozi di ferramenta locali o centri di bricolage.
D: Quali alimenti contengono solfito di sodio?
R: Na2SO3 è comunemente usato come conservante in alimenti come vino, birra, frutta secca e alcune carni lavorate.
D: Quale prodotto equivale al solfito di sodio?
R: Il bisolfito di sodio è un composto simile che può essere utilizzato come sostituto di Na2SO3 in alcune applicazioni. Altri sostituti possono includere metabisolfito di sodio o metabisolfito di potassio.
