Il tiosolfato di potassio (K2S2O3) è un composto chimico utilizzato in fotografia, come agente riducente e per neutralizzare il cloro nelle piscine. Ha un aspetto cristallino bianco ed è solubile in acqua.
| Nome IUPAC | Tiosolfato di potassio |
| Formula molecolare | K2S2O3 |
| numero CAS | 10294-66-3 |
| Sinonimi | Iposolfito di potassio, tiosolfato di potassio, tiosolfato di potassio pentaidrato, tiosolfato di potassio pentaidrato, solforotioato di potassio, acido solforotioico di potassio |
| InChI | InChI=1S/2K.H2O3S2/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
Proprietà del tiosolfato di potassio
Formula di tiosolfato di potassio
La formula chimica del tiosolfato di potassio (K2S2O3) indica il numero e il tipo di atomi presenti nel composto. La formula è composta da due atomi di potassio, due atomi di zolfo e tre atomi di ossigeno. Gli atomi di potassio hanno una carica positiva, mentre gli atomi di zolfo e ossigeno hanno una carica negativa.
Massa molare del tiosolfato di potassio
La massa molare di K2S2O3 è 190,33 g/mol. La massa molare è la massa di una mole di una sostanza e si calcola sommando le masse atomiche di tutti gli atomi nella formula chimica. Nel caso di K2S2O3, la formula è composta da due atomi di potassio, due atomi di zolfo e tre atomi di ossigeno.
Punto di ebollizione del tiosolfato di potassio
K2S2O3 non ha un punto di ebollizione perché si decompone prima di raggiungere il punto di ebollizione. La decomposizione avviene quando la temperatura raggiunge circa 100°C e viene rilasciata anidride solforosa. Pertanto, il composto generalmente non viene utilizzato in applicazioni ad alta temperatura.
Punto di fusione del tiosolfato di potassio
Il punto di fusione di K2S2O3 è 48,3°C. Questa temperatura è relativamente bassa rispetto ad altri composti chimici. Quando riscaldato a questa temperatura, il solido K2S2O3 diventerà un liquido.
Densità del tiosolfato di potassio g/mL
La densità di K2S2O3 è 1,667 g/mL. La densità è una misura della quantità di massa contenuta in un determinato volume. Questo valore significa che un millilitro di K2S2O3 ha una massa di 1.667 grammi.
Peso molecolare del tiosolfato di potassio
Il peso molecolare di K2S2O3 è 190,33 g/mol. Il peso molecolare è la somma dei pesi atomici di tutti gli atomi presenti nel composto. Viene spesso utilizzato per convertire tra moli e grammi di una sostanza.
Struttura del tiosolfato di potassio
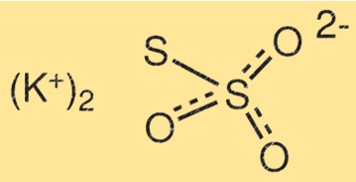
La struttura di K2S2O3 è costituita da due atomi di potassio, due atomi di zolfo e tre atomi di ossigeno. Gli atomi di zolfo sono uniti tra loro da un doppio legame, mentre l’altro atomo di zolfo è legato ad uno degli atomi di ossigeno. Gli atomi di potassio sono legati ai restanti atomi di ossigeno.
Solubilità del tiosolfato di potassio
K2S2O3 è altamente solubile in acqua, con una solubilità di 432 g/L a 20°C. Ciò lo rende un composto efficace per il trattamento dell’acqua e come agente fissativo fotografico. Tuttavia, non è solubile in solventi organici come etanolo o acetone.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 1.667 |
| Colore | Da incolore a bianco |
| Odore | Inodore |
| Massa molare | 190,33 g/mole |
| Densità | 1.667 g/ml |
| Punto di fusione | 48,3°C |
| Punto di ebollizione | Si rompe prima dell’ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile (432 g/L a 20°C) |
| Solubilità | Insolubile nei solventi organici |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | 6,0 – 9,0 (soluzione acquosa al 5%) |
Sicurezza e pericoli del tiosolfato di potassio
K2S2O3 è generalmente considerato sicuro da maneggiare e utilizzare quando vengono prese le dovute precauzioni. Tuttavia, è importante essere consapevoli di alcuni potenziali pericoli associati a questo composto. L’esposizione alla polvere o ai vapori di K2S2O3 può causare irritazione agli occhi, alla pelle e al sistema respiratorio. L’ingestione del composto può anche causare nausea, vomito e diarrea. Inoltre, il contatto con il composto può causare dermatiti o sensibilizzazione cutanea in alcune persone. Come con qualsiasi sostanza chimica, è importante seguire protocolli di sicurezza adeguati quando si maneggia K2S2O3 per evitare l’esposizione e ridurre il rischio di incidenti.
| Simboli di pericolo | XI |
| Descrizione della sicurezza | S22 – Non respirare le polveri. S24/25 – Evitare il contatto con la pelle e gli occhi. S37/39 – Usare guanti adatti e proteggersi gli occhi/la faccia. |
| Numeri di identificazione delle Nazioni Unite | ONU 3077 |
| Codice SA | 2832.10.00 |
| Classe di pericolo | 9 – Materiali pericolosi vari |
| Gruppo di imballaggio | III |
| Tossicità | LD50 (orale, ratto): 2.500 mg/kg |
Metodi per la sintesi del tiosolfato di potassio
K2S2O3 può essere sintetizzato con vari metodi, inclusa la reazione dello zolfo con solfito di potassio in presenza di un idrossido di metallo alcalino.
Un altro metodo prevede la reazione dell’idrossido di potassio con zolfo e anidride solforosa gassosa. Questa reazione produce K2S2O3 e solfato di potassio come sottoprodotti.
Un metodo di sintesi alternativo prevede la reazione del solfito di potassio con tiosolfato di sodio in una soluzione acquosa. Il precipitato risultante può essere filtrato e lavato per ottenere K2S2O3 puro.
Per preparare K2S2O3 in laboratorio, si può far reagire l’idrossido di potassio con lo zolfo, quindi aggiungere anidride solforosa gassosa alla miscela. Il prodotto risultante è un solido cristallino bianco che può essere ulteriormente purificato mediante ricristallizzazione.
Usi del tiosolfato di potassio
K2S2O3 ha diversi usi importanti in vari settori. Ecco alcune delle sue applicazioni più comuni:
- Fotografia: il tiosolfato di potassio viene utilizzato come agente fissante nell’elaborazione fotografica per rimuovere gli alogenuri d’argento non utilizzati e prevenire lo sbiadimento dell’immagine.
- Agricoltura: il tiosolfato di potassio viene utilizzato come fertilizzante per fornire alle piante zolfo e potassio, che sono nutrienti importanti per la crescita e lo sviluppo.
- Trattamento dell’acqua: il tiosolfato di potassio viene utilizzato per rimuovere il cloro dall’acqua delle piscine e delle terme, nonché per neutralizzare gli effetti del cloro nel trattamento delle acque reflue industriali.
- Chimica analitica: il tiosolfato di potassio viene utilizzato in chimica analitica come agente riducente per determinare la concentrazione di iodio e altri agenti ossidanti.
- Trattamenti medici: il tiosolfato di potassio è stato utilizzato in alcuni trattamenti medici, come il trattamento dell’avvelenamento da cianuro.
- Applicazioni industriali: il tiosolfato di potassio viene utilizzato in varie applicazioni industriali, come la galvanica, la concia della pelle e l’estrazione dell’olio.
Domande:
D: Come si determina se qualcosa è un agente riducente del tiosolfato di potassio?
R: K2S2O3 è un agente riducente perché ha la capacità di donare elettroni ad altre molecole o ioni, riducendone lo stato di ossidazione.
D: Cosa rende il tiosolfato di potassio un agente riducente?
R: K2S2O3 ha un atomo di zolfo con uno stato di ossidazione inferiore rispetto al solfato, che gli consente di donare elettroni ad altre molecole o ioni e di agire come agente riducente.
D: Il tiosolfato di potassio brucia le verdure verdi?
R: No, K2S2O3 non brucia i verdi. È un solido cristallino bianco e non mostra colorazione verde.
D: Qual è la solubilità molare di AgCl in K2S2O3 1,0 M?
R: La solubilità molare di AgCl in K2S2O3 1,0 M dipende da vari fattori come la temperatura e la forza ionica. Non è possibile determinare un valore preciso senza informazioni aggiuntive.
D: Qual è la carica o il numero di ossidazione di K in 2 (K2S2O3)?
R: La carica o numero di ossidazione di K in 2 (K2S2O3) è +1.
D: Qual è lo stato di ossidazione di S in K2S2O3?
R: Lo stato di ossidazione di S in K2S2O3 è +2.
D: Quante molecole ci sono in 4 moli di K2S2O3?
R: Ci sono circa 4 x 6.022 x 10^23 molecole di K2S2O3 in 4 moli di K2S2O3, che equivalgono a 2.409 x 10^24 molecole.
D: Quanto costano 4 moli di K2S2O3?
R: La massa di 4 moli di K2S2O3 può essere calcolata moltiplicando la massa molare di K2S2O3 (190,31 g/mol) per 4, che equivale a 761,24 grammi. Pertanto, 4 moli di K2S2O3 equivalgono a 761,24 grammi.
