Il tiosolfato di calcio (CaO3S2) è un composto composto da calcio, ossigeno e zolfo. È comunemente usato nell’industria medica e agricola come fertilizzante e come trattamento per determinate condizioni mediche.
| Nome IUPAC | Tiosolfato di calcio |
| Formula molecolare | CaO3S2 |
| numero CAS | 10124-41-1 |
| Sinonimi | Iposolfito di calcio; Tiosolfato di calcio; Solfidrato di calcio; Tiosolfonato di calcio |
| InChI | InChI=1S/Ca.H2O3S2/c;1-4(2)3/h;(H2,1,2,3)/q+2;/p-2 |
Proprietà del tiosolfato di calcio
Formula di tiosolfato di calcio
La formula chimica del tiosolfato di calcio è CaS2O3. Indica il tipo e il numero di atomi in una molecola. La formula può essere utilizzata per determinare la massa molare e altre proprietà del composto.
Massa molare del tiosolfato di calcio
La massa molare di CaO3S2 è 152,18 g/mol. È composto da un atomo di calcio, tre atomi di ossigeno e due atomi di zolfo. La massa molare è una proprietà importante utilizzata nei calcoli chimici, ad esempio per determinare la quantità di sostanza necessaria per produrre una determinata reazione.
Punto di ebollizione del tiosolfato di calcio
CaO3S2 non ha un punto di ebollizione definito perché si decompone prima di essere bollito. Inizia a decomporsi intorno ai 75°C e rilascia anidride solforosa. Il punto di ebollizione di una sostanza è la temperatura alla quale, ad una certa pressione, passa dallo stato liquido a quello gassoso.
Tiosolfato di calcio Punto di fusione
Il punto di fusione di CaO3S2 è 155°C. A questa temperatura il composto solido passa da solido a liquido. Il punto di fusione è una proprietà importante utilizzata per identificare e classificare le sostanze.
Densità del tiosolfato di calcio g/mL
La densità di CaO3S2 è 2,67 g/mL. La densità è la quantità di massa per unità di volume. La densità di una sostanza può essere utilizzata per determinare se galleggerà o affonderà in un’altra sostanza, come l’acqua.
Peso molecolare del tiosolfato di calcio
Il peso molecolare di CaO3S2 è 152,18 g/mol. È la somma dei pesi atomici di tutti gli atomi di una molecola. Il peso molecolare viene utilizzato per calcolare varie proprietà di una sostanza, come la sua molarità o concentrazione.
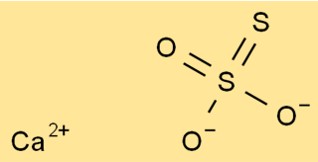
Struttura del tiosolfato di calcio
La struttura di CaO3S2 è composta da uno ione Ca2+ e uno ione S2O32-. Lo ione tiosolfato ha un atomo di zolfo centrale a cui sono attaccati quattro atomi di ossigeno. Due atomi di ossigeno hanno legami doppi e due sono legami singoli.
Solubilità del tiosolfato di calcio
CaO3S2 è leggermente solubile in acqua, con una solubilità di circa 16 g/L a temperatura ambiente. È più solubile in acqua calda che in acqua fredda. La solubilità è la quantità massima di una sostanza che può dissolversi in un dato solvente a una temperatura e pressione specifiche.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 2,67 g/ml |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 152,18 g/mole |
| Densità | 2,67 g/ml |
| Punto di fusione | 155°C |
| Punto di ebollizione | Si rompe prima dell’ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | 16 g/l a temperatura ambiente |
| Solubilità | Leggermente solubile in acqua |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | 7.2 (dissociazione dell’acido tiosolfrico) |
| pH | 6,0-8,5 (soluzione acquosa all’1%) |
Sicurezza e pericoli del tiosolfato di calcio
CaO3S2 è generalmente considerato sicuro se maneggiato e utilizzato correttamente. Tuttavia, se inalato, può causare irritazione alla pelle e agli occhi e difficoltà respiratorie. Può anche causare irritazione gastrointestinale se ingerito. Quando si maneggia questo composto, è importante indossare adeguati dispositivi di protezione individuale, come guanti e protezione per gli occhi. In caso di contatto con la pelle lavare abbondantemente con acqua. In caso di contatto con gli occhi, sciacquare con acqua per almeno 15 minuti. In caso di ingestione o inalazione, consultare immediatamente un medico. CaO3S2 deve essere conservato in un’area fresca, asciutta e ben ventilata, lontano da materiali incompatibili.
| Simboli di pericolo | Xi (irritante) |
| Descrizione della sicurezza | Evitare di respirare polvere/fumi/gas/nebbia/vapori/aerosol. Indossare guanti/indumenti protettivi/proteggere gli occhi/il viso. |
| Numeri di identificazione delle Nazioni Unite | Non regolato |
| Codice SA | 2832.10.00 |
| Classe di pericolo | 6.1 (tossico) |
| Gruppo di imballaggio | III |
| Tossicità | LD50 (orale, ratto) 1064 mg/kg; LC50 (inalazione, ratto) >2.000 mg/m3 |
Metodi per la sintesi del tiosolfato di calcio
Esistono vari metodi per sintetizzare CaO3S2.
Un metodo prevede la reazione dell’idrossido di calcio (Ca(OH)2) con Na2S2O3 in acqua per produrre CaO3S2 e idrossido di sodio (NaOH).
Un altro metodo consiste nel far reagire il solfato di calcio (CaSO4) con il solfito di sodio (Na2SO3) e lo zolfo (S) in acqua per produrre CaO3S2 e solfato di sodio (Na2SO4).
CaO3S2 può essere ottenuto facendo reagire lo zolfo (S) e l’ossigeno (O2) con l’ossido di calcio (CaO) o il carbonato di calcio (CaCO3) in acqua. Questo metodo produce CaO3S2, solfato di calcio (CaSO4) e anidride carbonica (CO2) come sottoprodotti.
Per sintetizzare CaO3S2, Na2S2O3 può essere fatto reagire con cloruro di calcio (CaCl2) in acqua. Questo metodo produce CaO3S2 e cloruro di sodio (NaCl) come sottoprodotti.
Un altro metodo prevede la reazione dell’idrossido di calcio (Ca(OH)2) con l’anidride solforosa (SO2) e l’ossigeno (O2) in acqua per produrre CaO3S2 e solfito di calcio (CaSO3) come sottoprodotti.
Usi del tiosolfato di calcio
CaO3S2 ha vari usi in diversi settori. Alcuni dei suoi usi includono:
- Agricoltura – Utilizzato come fertilizzante per fornire calcio e zolfo alle piante.
- Fotografia – Utilizzato come agente fissante nell’elaborazione fotografica per rimuovere l’alogenuro d’argento in eccesso da stampe e negativi.
- Trattamento dell’acqua – Utilizzato per rimuovere il cloro dall’acqua e neutralizzare il cloro nelle acque reflue.
- Medicina – Utilizzato come trattamento per l’avvelenamento da cianuro perché reagisce con il cianuro per formare il tiocianato meno tossico.
- Industriale – Utilizzato in vari processi industriali, come la produzione di pasta di legno e carta, la raffinazione del petrolio e la lavorazione tessile.
- Industria alimentare – Utilizzato come conservante alimentare per prevenire la crescita di batteri e mantenere la freschezza degli alimenti.
- Salute degli animali – Utilizzato come integratore nutrizionale per gli animali per fornire loro calcio e zolfo.
- Cosmetici – Utilizzato nei cosmetici come agente condizionante per i capelli e idratante per la pelle.
Domande:
D: Cos’è più solubile in acqua, il tiosolfato di calcio o il tiosolfato di stronzio?
R: CaO3S2 è più solubile in acqua rispetto al tiosolfato di stronzio.
D: Quale pensi che sia più solubile in acqua, il tiosolfato di stronzio o il tiosolfato di calcio?
R: CaO3S2 dovrebbe essere più solubile in acqua rispetto al tiosolfato di stronzio.
D: Cosa costituisce un atomo di declorazione del tiosolfato di calcio?
R: Un atomo di declorazione CaO3S2 è costituito da un atomo di calcio, tre atomi di ossigeno, due atomi di zolfo e due ioni tiosolfato.
D: Come identificare il tiosolfato di calcio?
R: CaO3S2 può essere identificato attraverso le sue proprietà fisiche e chimiche, nonché attraverso varie tecniche analitiche, come la spettroscopia infrarossa e la diffrazione dei raggi X.
D: Cosa significano i numeri nel tiosolfato di calcio?
R: I numeri in CaO3S2 si riferiscono al numero di atomi di ciascun elemento presente nel composto. Ad esempio, CaO3S2 indica che esiste un atomo di calcio, tre atomi di ossigeno e due atomi di zolfo.
D: Cos’è il trattamento dell’acqua con tiosolfato di calcio?
R: CaO3S2 viene utilizzato nel trattamento dell’acqua per rimuovere il cloro dall’acqua e neutralizzare il cloro nelle acque reflue.
D: Esistono compresse di tiosolfato di calcio?
R: Sì, le compresse di CaO3S2 sono disponibili come integratore nutrizionale per gli animali, fornendo loro calcio e zolfo.
