Il nitrito di potassio (KNO2) è un composto chimico comunemente usato come conservante alimentare. È noto per inibire la crescita dei batteri e prevenire il deterioramento della carne e di altri alimenti.
| Nome IUPAC | Nitrito di potassio |
| Formula molecolare | KNO2 |
| numero CAS | 7758-09-0 |
| Sinonimi | Acido nitroso, sale di potassio; salnitro(III); acido nitroso, composto. con sale potassico (1:1); E249 |
| InChI | InChI=1S/K.NO2/c;2-1-3/q+1;-1 |
Proprietà del nitrito di potassio
Formula di nitrito di potassio
La formula chimica del nitrito di potassio è KNO2. Rappresenta la composizione del composto in termini di atomi costituenti. La formula del nitrito di potassio viene utilizzata per calcolare la sua massa molare e il peso molecolare.
Massa molare del nitrito di potassio
La massa molare di KNO2 è 85,103 g/mol. Deriva dalla somma delle masse atomiche di potassio (39,10 g/mol), azoto (14,01 g/mol) e due atomi di ossigeno (2 x 16,00 g/mol). La massa molare di KNO2 è essenziale per determinare la quantità di sostanza presente in una determinata massa o volume.
Punto di ebollizione del nitrito di potassio
Il punto di ebollizione di KNO2 è 320°C (608°F). A questa temperatura il composto passa dalla fase liquida a quella gassosa. Il punto di ebollizione del KNO2 dipende da vari fattori, come la pressione e la purezza.
Punto di fusione del nitrito di potassio
Il punto di fusione di KNO2 è 441°C (826°F). A questa temperatura il composto solido si trasforma nella fase liquida. Il punto di fusione di KNO2 è un parametro cruciale nel determinare la sua idoneità per varie applicazioni, come la conservazione degli alimenti e la medicina.
Densità del nitrito di potassio g/mL
La densità di KNO2 è 1,915 g/mL a temperatura ambiente. La densità di una sostanza è definita come la massa della sostanza per unità di volume. La densità di KNO2 gioca un ruolo importante nel determinare le sue proprietà fisiche, come la solubilità e la reattività chimica.
Peso molecolare del nitrito di potassio
Il peso molecolare di KNO2 è 85,103 g/mol. È un parametro cruciale per determinare la stechiometria di una reazione che coinvolge KNO2. Il peso molecolare di KNO2 viene utilizzato anche per determinarne le proprietà fisiche e chimiche.
Struttura del nitrito di potassio
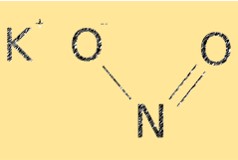
KNO2 ha una formula molecolare di KNO2. Ha una struttura ionica, con cationi potassio (K+) e anioni nitrito (NO2-). Lo ione nitrito ha una geometria molecolare curva, con un angolo di legame di circa 115°. La struttura di KNO2 è essenziale per determinare le sue proprietà chimiche, come la sua solubilità e reattività.
Solubilità del nitrito di potassio
KNO2 è molto solubile in acqua, con una solubilità di circa 710 g/L a 20°C. La solubilità del KNO2 dipende da vari fattori come la temperatura, la pressione e la presenza di altre sostanze. La solubilità di KNO2 è un parametro cruciale nel determinare la sua idoneità per varie applicazioni, come la conservazione degli alimenti e la medicina.
| Aspetto | Solido cristallino da bianco a giallastro |
| Peso specifico | 1.915 |
| Colore | Da incolore a bianco |
| Odore | Inodore |
| Massa molare | 85,103 g/mole |
| Densità | 1,915 g/ml |
| Punto di fusione | 441°C (826°F) |
| Punto di ebollizione | 320°C (608°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile (710 g/L a 20°C) |
| Solubilità | Solubile in etanolo, leggermente solubile in ammoniaca |
| Pressione del vapore | 0,0038 mmHg a 25°C |
| Densità del vapore | 2,96 (aria = 1) |
| pKa | 3.35 |
| pH | 5-8 (soluzione al 5%) |
Sicurezza e pericoli del nitrito di potassio
KNO2 può essere pericoloso se maneggiato in modo errato. È nocivo se ingerito o inalato e può causare irritazione agli occhi, alla pelle e al sistema respiratorio. L’esposizione prolungata o ripetuta al KNO2 può causare metaemoglobinemia, una condizione che riduce la capacità del sangue di trasportare ossigeno. KNO2 è anche un forte agente ossidante e può reagire violentemente con materiali combustibili, provocando un incendio o un’esplosione. Quando si maneggia KNO2 è necessario seguire misure di sicurezza adeguate, come l’uso di dispositivi di protezione, un’adeguata ventilazione e uno stoccaggio sicuro. In caso di ingestione o inalazione, consultare immediatamente un medico.
| Simboli di pericolo | Xn |
| Descrizione della sicurezza | S22, S24/25 |
| Numeri di identificazione delle Nazioni Unite | ONU 1488 |
| Codice SA | 2834.29.10 |
| Classe di pericolo | 5.1 |
| Gruppo di imballaggio | III |
| Tossicità | Nocivo se ingerito o inalato, può causare metaemoglobinemia |
Metodi di sintesi del nitrito di potassio
L’idrossido di potassio (KOH) reagisce con l’acido nitroso (HNO2) per sintetizzare KNO2. La reazione produce KNO2 e acqua (H2O) come sottoprodotti. L’industria utilizza comunemente questo metodo per produrre grandi quantità di KNO2.
L’equazione di reazione è:
2 KOH + HNO2 → KNO2 + 2 H2O
Un altro metodo per sintetizzare KNO2 consiste nel far reagire il carbonato di potassio (K2CO3) con l’ossido nitrico (NO). La reazione produce KNO2, anidride carbonica (CO2) e azoto (N2) come sottoprodotti. Ottenere l’ossido nitrico è difficile e costoso, rendendo questo metodo meno utilizzato.
L’equazione di reazione è:
2 K2CO3 + 2 NO → 2 KNO2 + 2 CO2 + N2
KNO2 può essere ottenuto ossidando KNO3 utilizzando un agente riducente come SO2 o FeSO4.
La reazione produce KNO2, acqua e la forma ridotta dell’agente riducente come sottoprodotti. Gli scienziati utilizzano questo metodo meno frequentemente e generalmente lo riservano a sintesi di laboratorio su piccola scala.
L’equazione per la reazione con l’anidride solforosa è:
2 KNO3 + 3 SO2 + H2O → 2 KNO2 + 3 H2SO4
Usi del nitrito di potassio
KNO2 ha diverse applicazioni industriali e di laboratorio grazie alle sue proprietà chimiche. Alcuni degli usi comuni di KNO2 sono:
- Conservazione degli alimenti: utilizzato come conservante nei salumi per prevenire la crescita di batteri nocivi e prolungarne la durata.
- Industria chimica: utilizzato come intermedio nella produzione di numerosi prodotti chimici, come acido nitroso, composti di diazonio e nitriti organici.
- Agricoltura: utilizzato come fertilizzante e ammendante grazie alla sua elevata solubilità in acqua e capacità di rilasciare azoto.
- Reagente di laboratorio: utilizzato come reagente in diverse applicazioni di laboratorio, come il rilevamento di ammine primarie e la preparazione di sali di diazonio.
- Uso medicinale: utilizzato nel trattamento dell’avvelenamento da cianuro perché reagisce con gli ioni di cianuro per formare cianmetemoglobina non tossica.
- Fotografia: utilizzato come additivo negli sviluppatori fotografici per migliorare la qualità e la chiarezza delle immagini sviluppate.
- Industria del vetro: utilizzato nell’industria del vetro come agente sbiancante per rimuovere colorazioni indesiderate dai prodotti in vetro.
Domande:
Cos’è il nitrito di potassio?
R: KNO2 è un composto inorganico comunemente utilizzato in varie applicazioni industriali e di laboratorio.
D: Qual è la formula del nitrito di potassio?
R: La formula chimica del nitrito di potassio è KNO2.
D: Quale sale viene prodotto quando NH4OH reagisce con HNO3? KNO2, NaNO3, NH4NO3 o NH4NO2?
R: Quando NH4OH reagisce con HNO3, il sale prodotto è NH4NO3.
D: KNO2 è un acido o una base?
R: KNO2 è un composto basico.
D: Qual è il nome del composto con la formula KNO2?
R: Il nome del composto con la formula KNO2 è nitrito di potassio.
D: KNO2 è una base debole?
R: KNO2 è considerata una base debole.
D: KNO2 è acido o basico?
R: KNO2 è di natura basica e può agire come un blando agente riducente.
