Il nitrito di calcio (Ca(NO2)2) è un composto chimico comunemente usato come inibitore della corrosione nel calcestruzzo. Aiuta a prevenire la corrosione dei rinforzi in acciaio.
| Nome dell’IUPAC | Dinitrito di calcio |
| Formula molecolare | Ca(NO2)2 |
| numero CAS | 13780-06-8 |
| Sinonimi | Nitrito di calcio diidrato, acido nitroso, sale di calcio, acido nitrico, sale di calcio, diidrato, ecc. |
| InChI | InChI=1S/Ca.2HNO2/c;2 2-1-3/h;2 (H,2,3) |
Proprietà del nitrito di calcio
Formula del nitrito di calcio
La formula chimica del nitrito di calcio è Ca(NO2)2. Questa formula indica che il composto contiene due anioni nitrito per ciascun catione di calcio. La formula è importante per determinare la composizione del composto e per determinare la quantità di ciascun elemento nel composto.
Massa molare del nitrito di calcio
La massa molare del Ca(NO2)2, noto anche come dinitrito di calcio, è di circa 132,09 g/mol. È un composto ionico composto da cationi calcio e anioni nitrito. La massa molare si calcola sommando le masse atomiche degli elementi costitutivi del composto, che in questo caso sono calcio, azoto e ossigeno.
Punto di ebollizione del nitrito di calcio
Ca(NO2)2 ha un punto di ebollizione elevato di circa 400°C (752°F). Questo alto punto di ebollizione è dovuto ai forti legami ionici che esistono tra gli ioni Ca2+ e NO2- nel composto. Quando il Ca(NO2)2 viene riscaldato, subisce una decomposizione termica, rilasciando biossido di azoto e ossigeno.
Nitrito di calcio Punto di fusione
Ca(NO2)2 ha un punto di fusione di circa 132°C (270°F). Questo punto di fusione è relativamente basso rispetto ad altri composti ionici, come il cloruro di sodio, che ha un punto di fusione di 801°C (1.474°F). Il basso punto di fusione del Ca(NO2)2 può essere attribuito ai legami ionici relativamente deboli che esistono tra gli ioni Ca2+ e NO2-.
Densità del nitrito di calcio g/mL
La densità di Ca(NO2)2 è di circa 2,32 g/mL. Questo valore indica che Ca(NO2)2 è un composto relativamente denso. La densità si calcola dividendo la massa del composto per il suo volume. L’elevata densità di Ca(NO2)2 può essere attribuita alla presenza di cationi calcio relativamente pesanti.
Peso molecolare del nitrito di calcio
Il peso molecolare di Ca(NO2)2 è di circa 132,09 g/mol. Questo valore si calcola sommando i pesi atomici degli elementi costitutivi del composto. Il peso molecolare è importante per determinare la quantità di Ca(NO2)2 necessaria per ottenere un certo numero di moli del composto.
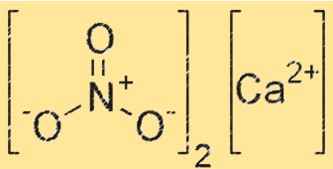
Struttura del nitrito di calcio
La struttura di Ca(NO2)2 è composta da Ca2+ e NO2-. Gli ioni Ca2+ si trovano al centro del reticolo cristallino, mentre gli ioni NO2- li circondano. Il reticolo cristallino è tenuto insieme da forti legami ionici tra gli ioni Ca2+ e NO2-.
Solubilità del nitrito di calcio
Ca(NO2)2 è solubile in acqua e alcol. La solubilità in acqua è relativamente elevata, con una solubilità di circa 61 g/100 ml di acqua a temperatura ambiente. La solubilità in alcool è inferiore a quella in acqua. La solubilità del Ca(NO2)2 è importante per determinarne l’utilizzo in varie applicazioni, come nella produzione di calcestruzzo.
| Aspetto | Polvere cristallina o solido da bianco a leggermente giallo |
| Peso specifico | 2.32 |
| Colore | Da incolore a bianco |
| Odore | Inodore |
| Massa molare | 132,09 g/mole |
| Densità | 2,32 g/ml |
| Punto di fusione | 132°C (270°F) |
| Punto di ebollizione | Si decompone a circa 400°C (752°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | Solubile |
| Solubilità | Solubile in acqua e alcool |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Neutro |
Sicurezza e pericoli del nitrito di calcio
Il Ca(NO2)2 può essere dannoso se ingerito, inalato o a contatto con la pelle o gli occhi. Ciò può causare irritazioni, ustioni e problemi respiratori. Il composto è anche un agente ossidante e può reagire con altri prodotti chimici, come acidi e metalli, per formare sostanze pericolose. Il Ca(NO2)2 deve essere conservato in un’area fresca, asciutta e ben ventilata, lontano da materiali incompatibili. Durante la manipolazione del composto è necessario indossare dispositivi di protezione individuale, come guanti e occhiali protettivi. In caso di esposizione, è necessario richiedere assistenza medica immediata e rimuovere gli indumenti contaminati.
| Simboli di pericolo | Xn |
| Descrizione della sicurezza | Evitare il contatto con la pelle e gli occhi; indossare i dispositivi di protezione individuale (DPI); In caso di esposizione, consultare immediatamente un medico. |
| Numeri di identificazione delle Nazioni Unite | ONU 1454 |
| Codice SA | 2834.29.90 |
| Classe di pericolo | 5.1 |
| Gruppo di imballaggio | III |
| Tossicità | Nocivo se ingerito o inalato; può causare irritazioni, ustioni e problemi respiratori |
Metodi di sintesi del nitrito di calcio
Vari metodi possono sintetizzare Ca(NO2)2, inclusa la reazione dell’acido nitrico o degli ossidi di azoto con carbonato di calcio , la reazione dell’acido nitroso o degli ossidi di azoto con idrossido di carbonio. calcio e la reazione dell’idrossido di calcio o dell’idrossido di ammonio con nitrato di calcio.
Un metodo comune consiste nel far reagire il carbonato di calcio con l’acido nitrico per produrre nitrato di calcio. Quindi, la reazione del nitrato di calcio con l’idrossido di calcio porta alla formazione di sottoprodotti di Ca(NO2)2 e ossido di calcio.
Un altro metodo prevede la reazione degli ossidi di azoto con l’idrossido di calcio per produrre Ca(NO2)2 e nitrato di calcio.
In un altro metodo, è possibile far reagire il nitrato di calcio con idrossido di calcio o idrossido di ammonio per produrre Ca(NO2)2 generando al contempo nitrato di calcio come sottoprodotto.
Usi del nitrito di calcio
Ca(NO2)2 ha varie applicazioni in diversi settori, tra cui:
- Industria del calcestruzzo: utilizzato come additivo per il calcestruzzo per aumentare la durabilità e la resistenza delle strutture in calcestruzzo. Agisce come inibitore della corrosione, proteggendo l’acciaio d’armatura dalla corrosione causata da cloruri e altri ioni aggressivi.
- Agricoltura: utilizzato come fertilizzante in agricoltura per fornire una fonte di azoto e calcio alle piante. Utilizzato anche come ammendante del terreno per migliorare la qualità del suolo e promuovere la crescita delle piante.
- Industria chimica: utilizzato come agente riducente nelle reazioni chimiche, nonché precursore per la sintesi di altri prodotti chimici come il nitrato di calcio e il nitrato di calcio e ammonio.
- Trattamento delle acque reflue: utilizzato come prodotto chimico per il trattamento delle acque reflue per rimuovere i contaminanti e ridurre la concentrazione di sostanze nocive nell’acqua.
- Industria alimentare: utilizzato come conservante alimentare per prevenire la crescita di batteri e altri microrganismi nella carne, nel pesce e in altri prodotti alimentari.
Domande:
D: Qual è la formula del nitrito di calcio?
R: La formula chimica del nitrito di calcio è Ca(NO2)2.
D: Quanto nitrito di calcio viene utilizzato ogni anno nel calcestruzzo?
R: La quantità di Ca(NO2)2 utilizzata nel calcestruzzo ogni anno varia a seconda dell’applicazione specifica e della domanda del mercato. Tuttavia, si stima che diverse migliaia di tonnellate di Ca(NO2)2 vengano utilizzate ogni anno in tutto il mondo come additivo per calcestruzzo.
D: Il nitrito di calcio è solubile in acqua?
R: Sì, il Ca(NO2)2 è solubile in acqua. Ha una solubilità di circa 167 g/L a 20°C.
D: Il nitrito di calcio è un sale?
R: Sì, Ca(NO2)2 è sale. Un composto ionico composto da cationi calcio (Ca2+) e anioni nitrito (NO2-).
D: Come verrebbero preparate le seguenti soluzioni? 1,25 l di una soluzione da 0,775 m di Ca(NO2)2
R: Per preparare 1,25 L di una soluzione 0,775 M di Ca(NO2)2, dovresti sciogliere circa 187,5 g di Ca(NO2)2 in acqua sufficiente per ottenere un volume finale di 1,25 L. Questo può essere calcolato utilizzando il formula formula: grammi di soluto = Molarità x volume (in litri) x massa molare di soluto.
D: Qual è la formula del composto ionico per il nitrito di calcio?
R: La formula del composto ionico per Ca(NO2)2 è Ca(NO2)2. È composto da uno ione calcio (Ca2+) e due ioni nitrito (NO2-).
