Il bromo (Br2) è una molecola biatomica composta da due atomi di bromo. È un liquido bruno-rossastro a temperatura ambiente e molto reattivo. Viene utilizzato in vari settori tra cui quello farmaceutico, l’agricoltura e il trattamento delle acque.
| Nome IUPAC | Bromo |
| Formula molecolare | Br2 |
| numero CAS | 7726-95-6 |
| Sinonimi | Bromo, Bromo molecolare, ONU 1744, Bromo biatomico, Bromo-79, Bromo-81 |
| InChI | InChI=1S/Br2/c1-2 |
Proprietà del bromo
Formula del bromo
La formula chimica del bromo è Br2. Ciò significa che una molecola di bromo contiene due atomi di bromo. La formula viene utilizzata per rappresentare la composizione di una sostanza ed è essenziale nelle reazioni chimiche. La formula del bromo viene utilizzata in vari settori, tra cui quello farmaceutico, il trattamento delle acque e l’agricoltura.
Massa molare del bromo
La massa molare di Br2 è 159,808 g/mol. È la massa di una mole di molecole di Br2. La massa molare è una proprietà essenziale in chimica perché aiuta a determinare la quantità di sostanza necessaria per una determinata reazione. Viene anche utilizzato per convertire grammi e moli di una sostanza.
Punto di ebollizione del bromo
Br2 ha un punto di ebollizione di 58,8°C (137,8°F). Questa è la temperatura alla quale Br2 passa da liquido a gassoso. Il basso punto di ebollizione di Br2 è dovuto alle sue deboli forze intermolecolari, che consentono alle molecole di fuoriuscire più facilmente dallo stato liquido. L’elevata reattività di Br2 lo rende una sostanza pericolosa da maneggiare ad alte temperature.
Punto di fusione del bromo
Il punto di fusione di Br2 è -7,2°C (19,0°F). Questa è la temperatura alla quale il Br2 solido passa allo stato liquido. Il basso punto di fusione del Br2 è dovuto alle sue deboli forze intermolecolari, che consentono alle molecole di muoversi più facilmente allo stato solido. Br2 ha la proprietà unica di esistere in forma liquida a temperatura ambiente, cosa rara tra gli alogeni.
Densità del bromo g/mL
La densità di Br2 è 3,12 g/mL. Ciò significa che un millilitro di Br2 ha una massa di 3,12 grammi. L’elevata densità di Br2 è dovuta al suo peso molecolare e alla tenuta delle sue molecole allo stato liquido. L’elevata densità di Br2 lo rende utile nelle reazioni di sintesi organica pesante.
Peso molecolare del bromo
Il peso molecolare di Br2 è 79,90 g/mol. È la somma dei pesi atomici dei due atomi di Br nella molecola Br2. Il peso molecolare è una proprietà essenziale in chimica perché aiuta a determinare la quantità di sostanza necessaria per una determinata reazione.
Struttura del bromo
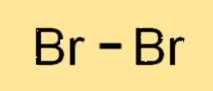
Br2 è una molecola biatomica, il che significa che è composta da due atomi di Br legati insieme. I due atomi di Br2 condividono una coppia di elettroni formando un legame covalente. La molecola di Br2 ha una struttura lineare, con i due atomi di Br disposti in linea retta. La struttura di Br2 è simile ad altri alogeni come cloro e iodio.
| Aspetto | Liquido bruno-rossastro |
| Peso specifico | 3,12 g/ml |
| Colore | Marrone rossastro |
| Odore | Odore pungente e irritante |
| Massa molare | 159.808 g/mole |
| Densità | 3,12 g/ml |
| Punto di fusione | -7,2°C (19,0°F) |
| Punto di ebollizione | 58,8°C (137,8°F) |
| Punto flash | Non infiammabile |
| solubilità in acqua | 3,41 g/100 ml (25°C) |
| Solubilità | Solubile in cloroformio, tetracloruro di carbonio ed etere |
| Pressione del vapore | 1,13 kPa a 25°C |
| Densità del vapore | 5,4 g/l |
| pKa | -5 |
| pH | Non applicabile |
Sicurezza e pericoli del bromo
Br2 è una sostanza chimica pericolosa e deve essere maneggiata con cura. È un liquido corrosivo che può causare gravi irritazioni alla pelle e agli occhi. L’inalazione dei vapori di Br2 può causare problemi respiratori e l’esposizione a livelli elevati può essere fatale. Br2 è anche un forte agente ossidante e può reagire violentemente con materiali infiammabili, provocando incendi o esplosioni. Quando si lavora con Br2 è necessario indossare sempre dispositivi di protezione adeguati, come guanti, occhiali e respiratori. Deve essere conservato in un luogo fresco, asciutto e ben ventilato, lontano da fonti di calore e materiali incompatibili. In caso di fuoriuscita o incidente, evacuare immediatamente l’area e seguire le corrette procedure di pulizia.
| Simboli di pericolo | Teschio e Ossa Incrociate, Corrosivo |
| Descrizione della sicurezza | Molto tossico, corrosivo e irritante per la pelle, gli occhi e il sistema respiratorio. |
| Numeri di identificazione delle Nazioni Unite | ONU1744 |
| Codice SA | 2801.30 |
| Classe di pericolo | 8 |
| Gruppo di imballaggio | II |
| Tossicità | LD50 (orale, ratto) = da 2 a 3 mg/kg |
Metodi di sintesi del bromo
È possibile utilizzare diversi metodi per sintetizzare Br2, a seconda della purezza e della quantità desiderate.
Un metodo prevede il trattamento della salamoia con cloro gassoso in presenza di un catalizzatore come il ferro. La soluzione risultante di ipoclorito di sodio e cloruro di sodio viene quindi acidificata con acido cloridrico, che rilascia gas Br2.
Un altro metodo prevede l’ossidazione del gas acido bromidrico con ossigeno gassoso in presenza di un catalizzatore come platino o amianto. Le industrie utilizzano comunemente questo metodo per produrre Br2 ad elevata purezza per le loro applicazioni.
L’elettrolisi estrae Br2 dalla salamoia facendo passare una corrente elettrica attraverso la soluzione, che separa gli ioni sodio e cloruro e produce gas Br2 come sottoprodotto.
Usi del bromo
Br2 ha diversi usi importanti in vari settori, tra cui:
- I produttori utilizzano composti a base di Br come ritardanti di fiamma nei tessuti, nella plastica e nelle apparecchiature elettroniche per ridurre il rischio di incendio prevenendo la propagazione delle fiamme.
- Le aziende farmaceutiche incorporano composti a base di Br nella produzione di vari sedativi, tranquillanti e analgesici.
- Gli impianti di trattamento dell’acqua utilizzano composti a base di Br come disinfettante per uccidere efficacemente batteri, virus e altri organismi nocivi.
- I produttori di pesticidi ed erbicidi utilizzano composti a base di Br per controllare efficacemente parassiti ed erbe infestanti.
- L’industria del petrolio e del gas utilizza composti a base di Br nelle operazioni di perforazione per controllare la corrosione e migliorare il recupero del petrolio.
- I produttori utilizzano composti a base di Br nella produzione di pellicole e carte fotografiche per controllare efficacemente la sensibilità e il contrasto delle immagini.
- Le reazioni di sintesi chimica utilizzano Br2 come reagente per produrre coloranti, plastica e prodotti farmaceutici.
Domande:
D: Br2 è polare o non polare?
R: Br2 è una molecola non polare perché entrambi gli atomi di bromo hanno la stessa elettronegatività, con conseguente equa condivisione degli elettroni nel legame covalente.
D: Quale composto contiene molto probabilmente legami covalenti polari? NaCl, AlF3, Br2, NF3?
R: Il composto che molto probabilmente contiene legami covalenti polari è NF3 (trifluoruro di azoto), perché gli atomi di azoto e fluoro hanno elettronegatività molto diverse, con conseguente condivisione ineguale di elettroni nel legame covalente.
D: Qual è ΔH0 per questa reazione? Br2 (g) → Br2 (l), ΔHf° Br2 (g) = 30,91 kJ/mol
R: Il ΔH0 per la reazione è -10,57 kJ/mol, perché il calore di vaporizzazione di Br2 è 41,48 kJ/mol e il calore di fusione è 30,91 kJ/mol (indicato nella domanda).
D: Br2 è un gas?
R: Br2 può esistere allo stato gassoso e liquido a seconda delle condizioni di temperatura e pressione. A temperatura ambiente e pressione standard, Br2 è un liquido bruno-rossastro.
D: A cosa serve il bromo?
R: Il bromo ha diversi usi importanti in vari settori, tra cui ritardanti di fiamma, trattamento delle acque, prodotti farmaceutici, pesticidi, industria petrolifera e del gas, fotografia e sintesi chimica.
D: Il bromo è un metallo?
R: No, il bromo non è un metallo. È un elemento non metallico nel gruppo alogeno della tavola periodica.
