Il propilene (C3H6) è un gas incolore e infiammabile comunemente utilizzato nella produzione di plastica e fibre sintetiche. Viene anche utilizzato come combustibile nei cannelli per saldatura e taglio.
| Nome dell’IUPAC | Propene |
| Formula molecolare | C3H6 |
| numero CAS | 115-07-1 |
| Sinonimi | Propilene, metiletilene, prop-1-ene, metiletilene |
| InChI | InChI=1S/C3H6/c1-3-2/h3H,1-2H3 |
Proprietà del propilene
Formula di propilene
La formula chimica del propilene è C3H6. Ciò significa che ciascuna molecola di propilene contiene tre atomi di carbonio e sei atomi di idrogeno. La formula è importante nelle reazioni chimiche perché indica il numero e il tipo di atomi presenti in ciascuna molecola. La formula del propilene viene spesso utilizzata nella produzione di plastica, fibre sintetiche e altri materiali industriali.
Massa molare del propilene
Il propene, chiamato anche propene, ha una massa molare di 42,08 g/mol. Ciò significa che una mole di molecole di propene pesa 42,08 grammi. La massa molare è importante nei calcoli chimici perché ci consente di convertire tra la massa e le moli di una sostanza. Per calcolare la massa molare del propene, aggiungiamo le masse atomiche dei suoi atomi costituenti: tre atomi di carbonio, ciascuno con una massa di 12,01 amu, e sei atomi di idrogeno, ciascuno con una massa di 1,01 amu.
Punto di ebollizione del propilene
Il punto di ebollizione del propene è -47,6°C (-53,7°F). Ciò significa che alla normale pressione atmosferica il propene bolle e si trasforma in gas a -47,6°C. Il punto di ebollizione è un’importante proprietà fisica del propene perché determina le condizioni in cui la sostanza cambierà da liquido a gas. Il basso punto di ebollizione del propene lo rende utile come refrigerante e nella produzione di prodotti chimici.
Punto di fusione del propilene
Il propene non ha un punto di fusione ben definito perché subisce una transizione graduale da solido a liquido quando riscaldato. Tuttavia, l’intervallo di fusione del propene è compreso tra -185 e -135 °C (tra -301 e -211 °F) circa. Ciò significa che il propene inizierà a sciogliersi intorno a -185°C e si scioglierà completamente intorno a -135°C. Il punto di fusione è importante nel determinare le condizioni in cui il propene cambierà da solido a liquido.
Densità del propilene g/mL
La densità del propene è 0,74 g/mL a temperatura ambiente (25°C). Ciò significa che un millilitro di propene pesa 0,74 grammi. La densità è un’importante proprietà fisica del propene perché aiuta a determinare la massa di un dato volume della sostanza. La bassa densità del propene lo rende utile nelle applicazioni in cui è richiesto un materiale leggero.
Peso molecolare del propilene
Il peso molecolare del propene è 42,08 g/mol. Questo valore è la somma dei pesi atomici di tutti gli atomi in una singola molecola di propene. Il peso molecolare è una proprietà importante perché ci permette di calcolare la quantità di una sostanza in moli dalla sua massa o viceversa.
Struttura in propilene
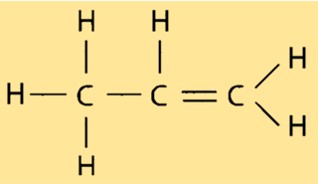
Il propene ha una struttura molecolare lineare, con ciascun atomo di carbonio legato a due atomi di idrogeno e un altro atomo di carbonio. Il doppio legame tra i due atomi di carbonio conferisce al propene la sua natura reattiva e lo rende utile in varie applicazioni industriali. La struttura del propene è importante nel determinare le sue proprietà, come il punto di ebollizione e il punto di fusione.
| Aspetto | Gas incolore |
| Peso specifico | 0,97 |
| Colore | Incolore |
| Odore | Odore leggermente dolce, simile alla benzina |
| Massa molare | 42,08 g/mole |
| Densità | 0,74 g/mL (a 25°C) |
| Punto di fusione | Da -185 a -135°C (da -301 a -211°F) |
| Punto di ebollizione | -47,6°C (-53,7°F) |
| Punto flash | -108°C (-162°F) |
| solubilità in acqua | 0,075 g/100 ml (a 20°C) |
| Solubilità | Solubile in acetone, etanolo, etere |
| Pressione del vapore | 50,6 kPa (a 25°C) |
| Densità del vapore | 1,45 (rispetto all’aria) |
| pKa | 44 |
| pH | Non applicabile (il propilene non è né acido né basico) |
Sicurezza e pericoli del propilene
Il propene è generalmente considerato un composto relativamente sicuro da maneggiare, ma presenta alcuni pericoli. È altamente infiammabile e può prendere fuoco facilmente. Deve pertanto essere immagazzinato e maneggiato lontano da fonti di ignizione. Il contatto con la pelle o gli occhi può causare irritazione e l’inalazione di elevate concentrazioni di propene può causare vertigini e persino perdita di coscienza. Come con qualsiasi sostanza chimica, è importante seguire adeguate procedure di sicurezza quando si maneggia il propene, come indossare indumenti protettivi come guanti e occhiali e garantire un’adeguata ventilazione. In caso di esposizione o ingestione accidentale, consultare immediatamente un medico.
| Simboli di pericolo | Facilmente infiammabile (F+) |
| Descrizione della sicurezza | Tenere lontano da fonti di ignizione. Utilizzare in aree ben ventilate. |
| Numeri di identificazione delle Nazioni Unite | ONU 1077 |
| Codice SA | 2901.10.00 |
| Classe di pericolo | 2.1 (gas infiammabile) |
| Gruppo di imballaggio | gruppo A |
| Tossicità | Non considerato tossico |
Metodi di sintesi del propilene
Vari metodi possono sintetizzare il propene, tra cui il cracking con vapore di idrocarburi, la deidrogenazione del propano e il cracking catalitico fluido.
Il cracking con vapore è il metodo più comune di sintesi del propene. Ciò comporta il riscaldamento di materie prime idrocarburiche, come etano, propano o nafta, ad alte temperature in presenza di vapore. Il processo prevede il raffreddamento e la separazione della miscela di idrocarburi risultante per isolare il propene come prodotto separato.
La deidrogenazione del propano è un altro metodo per sintetizzare il propene. Ciò comporta la reazione del propano con un catalizzatore per rimuovere l’idrogeno e produrre propene. Questo metodo è interessante perché il propano è facilmente disponibile ed economico.
Il processo di cracking catalitico fluido utilizza un catalizzatore per trasformare gli idrocarburi pesanti in prodotti più leggeri, compreso il propene, scomponendo le molecole più grandi in molecole più piccole.
Usi del propilene
Il propene è una sostanza chimica versatile che ha molti usi in vari settori. Ecco alcuni degli usi più comuni del propene:
- Produzione di polipropilene: svolge un ruolo cruciale come materia prima primaria nella produzione di polipropilene, un materiale versatile utilizzato in varie applicazioni, come imballaggi, tessuti e parti automobilistiche.
- Carburante: utilizzato come combustibile in molte applicazioni industriali, come l’ossitaglio e la saldatura.
- Solvente: serve come solvente utile per una varietà di prodotti chimici e le persone lo utilizzano in molte applicazioni, inclusa l’estrazione di oli essenziali.
- Refrigerante: utilizzato come refrigerante in alcuni sistemi, soprattutto in applicazioni in cui l’uso di altri refrigeranti è limitato.
- Intermedio chimico: utilizzato come intermedio chimico nella produzione di molti altri prodotti chimici, come ossido di propilene, acrilonitrile e butirraldeide.
- Imballaggio alimentare: utilizzato nella produzione di materiali per l’imballaggio alimentare, come pellicole e contenitori.
- Prodotti per la cura personale: molti prodotti per la cura personale, come creme idratanti e prodotti per la cura dei capelli, utilizzano glicole propilenico, un derivato del propene.
Domande:
D: Quale reazione dovrebbe essere utilizzata per convertire il propene in alogenuro alchilico?
R: Il propene può essere convertito in un alogenuro alchilico utilizzando una reazione con alogenuri di idrogeno, come acido cloridrico (HCl) o acido bromidrico (HBr).
D: Qual è la formula empirica del propene (c3h6)?
R: La formula empirica per il propene (C3H6) è CH2.
D: Il propene è solubile in acqua?
R: Il propene non è solubile in acqua perché è un composto non polare e l’acqua è un solvente polare.
D: Quali sono le masse formula del propene, C3H6?
R: La massa formula del propene (C3H6) è di circa 42,08 g/mol.
D: Qual è la formula empirica per la seguente formula molecolare: C3H6?
R: La formula empirica per C3H6 è CH2.
D: Come hai potuto dimostrare sperimentalmente che la formula molecolare del propene è C3H6, non CH2?
R: Un metodo sperimentale per determinare la formula molecolare del propene consiste nell’analizzare i suoi prodotti di combustione. Se il propene viene bruciato in eccesso di ossigeno, i prodotti saranno anidride carbonica e acqua. Misurando le quantità di anidride carbonica e acqua prodotte, è possibile determinare che la formula molecolare del propene è C3H6 anziché CH2.
