Il 2-butene (CH3CHCHCH3) è un gas incolore utilizzato nella produzione di vari prodotti chimici. È infiammabile ed emana un leggero odore. Il 2-butene è comunemente usato nella produzione di gomma sintetica e altri polimeri.
| Nome dell’IUPAC | Mais-2-ène |
| Formula molecolare | C4H8 o CH3CHCHCH3 |
| numero CAS | 624-64-6 |
| Sinonimi | 2-butene, butilene, etilene, but-2-ene, B-butene, butene-2 |
| InChI | InChI=1S/C4H8/c1-3-4-2/h3-4H,1-2H3 |
Proprietà del 2-butene
Formula 2-Butene
La formula chimica del 2-butene è C4H8. Ciò significa che la molecola contiene quattro atomi di carbonio e otto atomi di idrogeno. La formula fornisce informazioni sui tipi e sul numero di atomi presenti nella molecola, ma non fornisce informazioni sulla sua struttura o proprietà.
Massa molare del 2-butene
Il but-2-ene ha una massa molare di 56,11 g/mol. La massa molare è la massa di una mole di una sostanza e si calcola sommando le masse atomiche di tutti gli atomi della molecola. Per il but-2-ene ci sono quattro atomi di carbonio e otto atomi di idrogeno, per un totale di 56,11 g/mol.
Punto di ebollizione del 2-butene
Il punto di ebollizione del but-2-ene è 0,88°C. Il punto di ebollizione è la temperatura alla quale un liquido si trasforma in un gas. Nel caso del but-2-ene, è un gas incolore a temperatura ambiente, ma può essere condensato in un liquido abbassando la temperatura. A 0,88°C, il but-2-ene inizierà a bollire e si trasformerà in un gas.
Punto di fusione del 2-butene
Il but-2-ene non ha un punto di fusione distinto perché esiste come gas a temperatura ambiente. Tuttavia, se raffreddato a una temperatura sufficientemente bassa, può condensarsi in un liquido. A questo punto, la temperatura alla quale si solidifica dipenderà dalle condizioni dell’esperimento.
Densità del 2-butene g/mL
La densità del but-2-ene è 0,614 g/mL a temperatura e pressione ambiente. La densità è la quantità di massa per unità di volume. Nel caso del but-2-ene, ciò significa che per ogni millilitro di but-2-ene ci sono 0,614 grammi di massa.
Peso molecolare del 2-butene
Il peso molecolare del but-2-ene è 56,11 g/mol. Il peso molecolare è la somma dei pesi atomici di tutti gli atomi presenti in una molecola. Nel caso del but-2-ene, ci sono quattro atomi di carbonio e otto atomi di idrogeno, per un totale di 56,11 g/mol.
Struttura a 2-butene
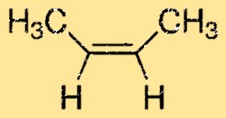
Il but-2-ene ha una struttura lineare e appartiene al gruppo degli alcheni. Ha due doppi legami carbonio-carbonio, che gli conferiscono la sua caratteristica reattività. La molecola ha un atomo di carbonio centrale con due gruppi metilici attaccati e due atomi di idrogeno attaccati a ciascuno degli atomi di carbonio alle estremità della molecola.
| Aspetto | Gas incolore |
| Densità specifica | 0,614 a 25°C |
| Colore | Incolore |
| Odore | Benigno |
| Massa molare | 56,11 g/mole |
| Densità | 0,614 g/ml a 25°C |
| Punto di fusione | -139,8°C |
| Punto di ebollizione | 0,88°C |
| Punto flash | -19°C |
| solubilità in acqua | Insolubile |
| Solubilità | Solubile in solventi organici |
| Pressione del vapore | 276,8 kPa a 25°C |
| Densità del vapore | 2,5 (aria = 1) |
| pKa | 44 |
| pH | Non applicabile |
Sicurezza e pericoli del 2-butene
Ma-2-ene può comportare diversi rischi per la sicurezza se non gestito correttamente. È altamente infiammabile e può accendersi facilmente se esposto a calore, fiamme o scintille. È anche irritante per le vie respiratorie e gli occhi e può causare vertigini, mal di testa e nausea se inalato. Inoltre, è dannoso se ingerito e può danneggiare gli organi interni. Durante la manipolazione del but-2-ene devono essere seguite misure di sicurezza adeguate, come l’uso di dispositivi di protezione e una buona ventilazione. È importante avere una formazione adeguata e conoscere i suoi potenziali pericoli prima di maneggiare la sostanza chimica.
| Simboli di pericolo | Infiammabile |
| Descrizione della sicurezza | Tenere lontano da fonti di calore/scintille/fiamme libere/superfici calde. Utilizzare apparecchiature elettriche/di ventilazione/illuminazione a prova di esplosione. Utilizzare solo strumenti antiscintilla. Adottare misure precauzionali contro le scariche elettrostatiche. Tieni il contenitore chiuso ermeticamente. Conservare in un’area ben ventilata. |
| Numeri di identificazione delle Nazioni Unite | UN1012 |
| Codice SA | 290110 |
| Classe di pericolo | 3 |
| Gruppo di imballaggio | II |
| Tossicità | Nocivo per ingestione, irritante per le vie respiratorie e gli occhi. |
Metodi per la sintesi del 2-butene
Vari metodi possono sintetizzare but-2-ene, compreso il cracking degli idrocarburi, la disidratazione del 2-butanolo e la deidrogenazione catalitica dei butani.
Il metodo di cracking prevede il riscaldamento di idrocarburi come nafta, diesel o cherosene ad alte temperature, facendoli scomporre in molecole più piccole, incluso il but-2-ene. Il processo può essere effettuato mediante cracking termico o catalitico.
Per produrre but-2-ene, le persone usano la disidratazione del 2-butanolo come altro metodo. In questo metodo, riscaldano il 2-butanolo con un agente disidratante, come acido solforico o acido fosforico , per creare but-2-ene e acqua. La reazione è reversibile e si può rimuovere l’acqua dalla miscela di reazione per spingere la reazione verso la formazione di but-2-ene.
Un altro metodo utilizzato per sintetizzare il but-2-ene è la deidrogenazione catalitica dei butani. Questo processo prevede il riscaldamento del butano su un catalizzatore come l’allumina di cromo o il platino per produrre but-2-ene e idrogeno. La reazione ha un’elevata esotermicità e i chimici possono eseguirla in un reattore a letto fisso o a letto fluidizzato.
Usi del 2-butene
Il But-2-ene ha una vasta gamma di applicazioni industriali e commerciali grazie alle sue proprietà chimiche uniche. Ecco alcuni usi comuni di but-2-ene:
- Produzione di butadiene: è un precursore del butadiene, una sostanza chimica utilizzata nella produzione di gomma sintetica e altri elastomeri.
- Produzione di materie plastiche: utilizzato nella produzione di polietilene ad alta densità (HDPE) e polietilene lineare a bassa densità (LLDPE).
- Additivo per carburante: utilizzato come additivo per carburante per aumentare il numero di ottani della benzina.
- Solvente: utilizzato come solvente in vari settori come vernici, rivestimenti e adesivi.
- Intermedio chimico: utilizzato come intermedio nella produzione di vari prodotti chimici come butanolo, butirraldeide e acido butirrico.
- Refrigerante: utilizzato come refrigerante in alcune applicazioni grazie al suo basso punto di ebollizione e alle buone proprietà di trasferimento del calore.
- Ricerca e sviluppo: utilizzato anche in ricerca e sviluppo per studiare la cinetica di reazione e la termodinamica di varie reazioni chimiche.
Domande:
D: Cosa descrive meglio la struttura del 2-butene?
R: Il but-2-ene è un idrocarburo insaturo con una catena di quattro atomi di carbonio e un doppio legame tra il secondo e il terzo atomo di carbonio.
D: Qual è l’ibridazione nei due atomi di carbonio centrali del 2-butene?
R: I due atomi di carbonio centrali del but-2-ene sono ibridati sp², il che significa che ciascuno di essi ha tre orbitali ibridati e un orbitale p non ibridato.
D: Quali reagenti possono essere utilizzati per convertire il cis-2-butene in trans-2-butene?
R: Reagenti come il bromo o l’idrogeno gassoso possono essere utilizzati per convertire il cis-but-2-ene in trans-but-2-ene attraverso un processo chiamato isomerizzazione cis-trans.
D: Perché potrebbe essere difficile visualizzare la separazione di cis- e trans-2-butene mediante TLC?
R: Può essere difficile visualizzare la separazione di cis- e trans-but-2-ene mediante cromatografia su strato sottile (TLC) perché i due isomeri hanno proprietà fisiche molto simili, come polarità e punto di origine. bollente, rendendo difficile differenziarli utilizzando la TLC.
D: Quanti stereoisomeri unici risultano dalla reazione che coinvolge il trans-but-2-ene?
R: La reazione che coinvolge trans-but-2-ene dà origine a due stereoisomeri unici, perché ci sono solo due possibili configurazioni di sostituenti attorno al doppio legame: trans e cis.
