Il bicarbonato di potassio (KHCO3) funge da sale cristallino bianco, ampiamente utilizzato come agente lievitante nella cottura al forno, come agente estinguente e per neutralizzare l’acidità del suolo in agricoltura. Inoltre, agisce come integratore nutrizionale e svolge un ruolo in trattamenti medici specifici.
| Nome IUPAC | Carbonato idrogeno di potassio |
| Formula molecolare | KHCO3 |
| numero CAS | 298-14-6 |
| Sinonimi | Carbonato acido di potassio, sale acido di potassio, carbonato acido di potassio, PCN 0775, E501 |
| InChI | InChI=1S/CH2O3.K/c2-1(3)4;/h(H2,2,3,4);/q;+1/p-1 |
Proprietà del bicarbonato di potassio
Formula di bicarbonato di potassio
La formula del bicarbonato di potassio è KHCO3. Questa formula indica che uno ione potassio (K+) è combinato con uno ione bicarbonato (HCO3-) per formare una molecola di bicarbonato di potassio. La formula è importante in chimica perché fornisce informazioni sui tipi e sul numero di atomi che compongono una molecola.
Massa molare del bicarbonato di potassio
KHCO3 ha una massa molare di 100,115 g/mol. Ciò significa che una mole di KHCO3 contiene 100,115 grammi del composto. La massa molare è una proprietà importante di un composto perché viene utilizzata per calcolare la quantità di sostanza necessaria per una reazione chimica. Inoltre, la massa molare può essere utilizzata per convertire grammi e moli di una sostanza.
Punto di ebollizione del bicarbonato di potassio
Il punto di ebollizione del KHCO3 non è ben definito poiché si decompone prima di raggiungere il punto di ebollizione. Quando riscaldato, KHCO3 si decompone in carbonato di potassio, anidride carbonica e acqua. Pertanto, la temperatura di decomposizione del KHCO3 viene utilizzata per descrivere la sua stabilità termica.
Punto di fusione del bicarbonato di potassio
KHCO3 ha un punto di fusione di 292°C. A questa temperatura, KHCO3 passa da solido a liquido. Il punto di fusione di un composto è una proprietà fisica importante perché determina le condizioni in cui il composto può essere fuso e lavorato.
Densità del bicarbonato di potassio g/mL
La densità di KHCO3 è 2,17 g/mL. La densità è una misura della quantità di massa per unità di volume. L’elevata densità di KHCO3 lo rende un composto utile in applicazioni come gli estintori, dove viene utilizzato per estinguere gli incendi di Classe B.
Peso molecolare del bicarbonato di potassio
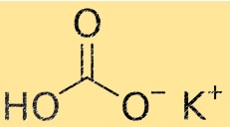
Il peso molecolare di KHCO3 è 100,115 g/mol. Il peso molecolare è la somma dei pesi atomici di tutti gli atomi presenti in una molecola. Questa proprietà è importante in chimica perché viene utilizzata per calcolare la quantità di sostanza necessaria per una reazione chimica.
Struttura del bicarbonato di potassio
KHCO3 ha una struttura cristallina simile al cloruro di sodio. Il composto è composto da ioni potassio (K+) e ioni bicarbonato (HCO3-). Gli ioni potassio occupano le posizioni degli ioni sodio nella struttura cristallina del cloruro di sodio, mentre gli ioni bicarbonato occupano le posizioni degli ioni cloruro.
| Aspetto | Polvere cristallina bianca |
| Peso specifico | 2,17 g/cm³ |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 100,115 g/mole |
| Densità | 2,17 g/cm³ |
| Punto di fusione | 292°C |
| Punto di ebollizione | Si rompe prima dell’ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | 25 g/100 ml (20°C) |
| Solubilità | Solubile in acqua |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | 10,3 (acido carbonico) |
| pH | 8,5 – 9,5 (soluzione all’1%) |
Sicurezza e pericoli del bicarbonato di potassio
KHCO3 è generalmente considerato sicuro se usato come indicato. Tuttavia, può causare irritazione alla pelle e agli occhi e deve essere maneggiato con cura. Può anche essere dannoso se ingerito in grandi quantità. L’inalazione di polvere può causare irritazione delle vie respiratorie. Inoltre, può reagire con acidi forti rilasciando anidride carbonica, che può essere pericolosa. Quando si utilizza KHCO3, è importante seguire le procedure di sicurezza e indossare dispositivi di protezione adeguati. In caso di ingestione, consultare immediatamente un medico. In caso di contatto con la pelle o gli occhi, lavare abbondantemente la zona interessata con acqua e consultare un medico se l’irritazione persiste.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | Nocivo se ingerito, provoca irritazione alla pelle e agli occhi. Evitare l’inalazione. |
| Numeri di identificazione delle Nazioni Unite | ONU 2987 |
| Codice SA | 2836.30.00 |
| Classe di pericolo | 8 (Corrosivo) |
| Gruppo di imballaggio | III |
| Tossicità | LD50 (ratto, orale): 6.400 mg/kg |
Metodi per la sintesi del bicarbonato di potassio
In presenza di acqua, l’anidride carbonica reagisce con il carbonato di potassio per sintetizzare KHCO3.
La reazione avviene come segue:
K2CO3 + CO2 + H2O → 2KHCO3
Un altro metodo consiste nel far reagire l’idrossido di potassio con l’anidride carbonica:
KOH + CO2 → KHCO3
Il KHCO3 risultante può quindi essere purificato mediante ricristallizzazione dall’acqua. La resa della reazione dipende dalla purezza delle materie prime e dalle condizioni di reazione.
Per produrre KHCO3, il cloruro di potassio può essere fatto reagire con bicarbonato di ammonio, quindi trattato con anidride carbonica.
NH4HCO3 + KCl → NH4Cl + KHCO3
KHCO3 + CO2 → K2CO3 + H2O
K2CO3 + CO2 + H2O → 2KHCO3
Questo metodo ha il vantaggio di utilizzare materie prime poco costose e di non produrre sottoprodotti pericolosi.
Usi del bicarbonato di potassio
KHCO3 ha una vasta gamma di usi in vari settori e applicazioni. Ecco alcuni degli usi più comuni:
- Industria alimentare: utilizzato come agente lievitante nei prodotti da forno, come torte, biscotti e pane, per favorirne la lievitazione.
- Agricoltura: utilizzato come fungicida per controllare le malattie fungine delle piante, come l’oidio.
- Prodotti farmaceutici: utilizzati negli antiacidi per neutralizzare l’acido dello stomaco e trattare l’indigestione e il bruciore di stomaco.
- Estintori: utilizzato negli estintori come agente chimico secco per estinguere gli incendi di Classe B e Classe C.
- Applicazioni di laboratorio: utilizzato in varie applicazioni di laboratorio, come tamponamento del pH e colture cellulari.
- Prodotti per la cura personale: utilizzati nei dentifrici come abrasivi delicati e nei deodoranti per aiutare a controllare gli odori.
- Trattamento dell’acqua: utilizzato nel trattamento dell’acqua per regolare il livello di pH e rimuovere metalli pesanti e altre impurità.
Domande:
D: Cos’è il bicarbonato di potassio?
R: KHCO3 è una polvere bianca e inodore comunemente utilizzata in vari settori, come quello alimentare, agricolo e farmaceutico. Ha la formula chimica KHCO3 ed è un sale composto da catione potassio, anione bicarbonato e molecole d’acqua.
D: Il bicarbonato contenuto nelle compresse effervescenti di potassio si trasforma in anidride carbonica?
R: Sì, quando le compresse effervescenti di potassio si sciolgono in acqua, il bicarbonato nella compressa reagisce con l’acido citrico per rilasciare anidride carbonica. Questa reazione produce il caratteristico frizzante e gorgogliante associato alle compresse effervescenti.
D: Cosa succede dopo aver aggiunto il bicarbonato di potassio al vino?
HA: L’aggiunta di KHCO3 al vino riduce l’acidità del vino reagendo con l’acido in eccesso presente. I produttori di vino utilizzano comunemente questo processo, chiamato disacidificazione, per migliorare il gusto e la qualità del vino.
D: Dove acquistare il bicarbonato di potassio?
R: KHCO3 può essere acquistato da vari fornitori di prodotti chimici, mercati online e negozi di forniture agricole. È anche comunemente disponibile nei negozi di alimenti naturali e nei mercati di alimenti naturali.
D: Qual è il nome del composto con la formula KHCO3?
R: Il composto con la formula KHCO3 è chiamato bicarbonato di potassio.
D: Cosa è stato fatto nell’esperimento per garantire che tutto il KHCO3 avesse reagito?
R: Nell’esperimento per garantire che tutto il KHCO3 avesse reagito, è stato aggiunto acido in eccesso alla miscela di reazione e la reazione è stata continuata finché non è stato prodotto più gas. L’assenza di gas indicava che tutto il KHCO3 aveva reagito con l’acido.
D: Cosa succede se riscaldi KHCO3?
R: Quando KHCO3 viene riscaldato, si decompone per formare carbonato di potassio (K2CO3), acqua e anidride carbonica. Questa reazione avviene come segue: 2KHCO3 → K2CO3 + H2O + CO2.
