L’acetato di calcio (Ca(C2H3O2)2) è un composto composto da calcio e acido acetico. È comunemente usato come farmaco per ridurre i livelli di fosfato nelle persone con malattie renali.
| Nome IUPAC | Acetato di calcio |
| Formula molecolare | Ca(C2H3O2)2 |
| numero CAS | 62-54-4 |
| Sinonimi | Acido acetico, sale di calcio; Acetato di calcio (francese); Diacetato di calcio; Etanoato di calcio; E263 |
| InChI | InChI=1S/2C2H4O2.Ca/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
Proprietà dell’acetato di calcio
Formula di acetato di calcio
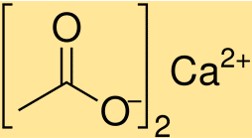
La formula dell’acetato di calcio è Ca(C2H3O2)2. Questa formula indica che una mole di acetato di calcio contiene una mole di ioni calcio (Ca2+) e due moli di ioni acetato (C2H3O2-). La formula dell’acetato di calcio è essenziale per determinare la stechiometria delle reazioni chimiche che coinvolgono questo composto.
Massa molare dell’acetato di calcio
La massa molare di Ca(C2H3O2)2 è 158,17 g/mol. Questo valore rappresenta la massa di una mole di Ca(C2H3O2)2, che è uguale al suo peso molecolare. La massa molare è un parametro cruciale nel determinare la stechiometria delle reazioni chimiche che coinvolgono Ca(C2H3O2)2. Questo valore si calcola sommando le masse atomiche di tutti gli atomi presenti in una mole di Ca(C2H3O2)2.
Punto di ebollizione dell’acetato di calcio
Il punto di ebollizione di Ca(C2H3O2)2 è 160°C (320°F). Questo valore indica la temperatura alla quale Ca(C2H3O2)2 cambia il suo stato da liquido a gassoso. Il punto di ebollizione di Ca(C2H3O2)2 è significativamente più alto di quello dell’acqua, che bolle a 100°C (212°F). Questo alto punto di ebollizione è dovuto alla natura ionica del Ca(C2H3O2)2 e alle sue forti forze intermolecolari.
Acetato di calcio Punto di fusione
Il punto di fusione di Ca(C2H3O2)2 è 160-170°C (320-338°F). Questo valore indica la temperatura alla quale Ca(C2H3O2)2 cambia il suo stato da solido a liquido. Il punto di fusione del Ca(C2H3O2)2 è leggermente superiore a quello dell’acqua, che fonde a 0°C (32°F). L’alto punto di fusione di Ca(C2H3O2)2 è dovuto alla natura ionica del composto e alle sue forti forze intermolecolari.
Densità dell’acetato di calcio g/mL
La densità di Ca(C2H3O2)2 è 1,5 g/mL. Questo valore indica la massa di Ca(C2H3O2)2 presente in un millilitro della sua soluzione. La densità di Ca(C2H3O2)2 è maggiore di quella dell’acqua, che ha una densità di 1 g/mL. L’elevata densità di Ca(C2H3O2)2 è dovuta alla sua natura ionica e alla presenza di ioni calcio nel composto.
Peso molecolare dell’acetato di calcio
Il peso molecolare di Ca(C2H3O2)2 è 158,17 g/mol. Questo valore rappresenta la somma dei pesi atomici di tutti gli atomi presenti in una molecola di Ca(C2H3O2)2. Il peso molecolare è un parametro critico nel determinare le proprietà del Ca(C2H3O2)2 e il suo comportamento nelle reazioni chimiche.
Struttura dell’acetato di calcio
La struttura del Ca(C2H3O2)2 è un composto ionico in cui gli ioni Ca2+ sono circondati da due ioni C2H3O2-. Gli ioni C2H3O2- agiscono come ligandi bidentati e formano legami di coordinazione con gli ioni Ca2+. La struttura di Ca(C2H3O2)2 è cristallina e ha una forma cubica.
| Aspetto | Polvere cristallina bianca |
| Peso specifico | 1,5 g/ml |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 158,17 g/mole |
| Densità | 1,5 g/ml |
| Punto di fusione | 160-170°C (320-338°F) |
| Punto di ebollizione | 160°C (320°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | Solubile |
| Solubilità | Solubile in acqua, etanolo e acetone |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | 9.24 |
| pH | 7-8 (soluzione al 5%) |
Sicurezza e pericoli dell’acetato di calcio
Ca(C2H3O2)2 è generalmente considerato sicuro se usato come indicato. Tuttavia, l’esposizione a grandi quantità di Ca(C2H3O2)2 può irritare la pelle, gli occhi e il sistema respiratorio. L’ingestione di grandi quantità di Ca(C2H3O2)2 può causare disturbi di stomaco, vomito e diarrea. È importante maneggiare Ca(C2H3O2)2 con cura ed evitare di inalare o ingerire la sostanza. Ca(C2H3O2)2 può anche rappresentare un rischio per l’ambiente, in particolare per la vita acquatica, e deve essere smaltito correttamente. Come per tutti i prodotti chimici, è importante leggere e seguire le istruzioni di sicurezza riportate sull’etichetta e utilizzare dispositivi di protezione adeguati quando si maneggia Ca(C2H3O2)2.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | Evitare l’inalazione, l’ingestione e il contatto con la pelle e gli occhi. Utilizzare in un’area ben ventilata e indossare dispositivi di protezione adeguati. |
| Numeri di identificazione delle Nazioni Unite | Non applicabile |
| Codice SA | 291529 |
| Classe di pericolo | Non classificato come pericoloso ai sensi della OSHA Hazard Communication (29 CFR 1910.1200). |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | Bassa tossicità. Può causare irritazione alla pelle e agli occhi. L’ingestione di grandi quantità può causare disturbi gastrointestinali. |
Metodi per la sintesi dell’acetato di calcio
Vari metodi possono essere utilizzati per sintetizzare Ca(C2H3O2)2.
Un metodo comune prevede la reazione del carbonato di calcio con acido acetico. Aggiungere il carbonato di calcio ad una soluzione di acido acetico e riscaldare la miscela a riflusso. Filtrare la miscela e consentire al filtrato di raffreddarsi e cristallizzare per formare Ca(C2H3O2)2.
Un altro metodo prevede la reazione dell’idrossido di calcio con acido acetico . Aggiungere l’idrossido di calcio alla soluzione di acido acetico. Mescolare e scaldare la miscela per ottenere una soluzione limpida. Filtrare la soluzione e consentire al filtrato di raffreddarsi e cristallizzare per formare Ca(C2H3O2)2.
Un altro metodo prevede la reazione dell’ossido di calcio con acido acetico . Aggiungere l’ossido di calcio alla soluzione di acido acetico. Mescolare e scaldare la miscela per ottenere una soluzione limpida. Filtrare la soluzione e consentire al filtrato di raffreddarsi e cristallizzare per formare Ca(C2H3O2)2.
La scelta del metodo di sintesi può dipendere da fattori quali la resa desiderata e la purezza del prodotto, nonché dall’applicazione specifica per la quale verrà utilizzato il Ca(C2H3O2)2.
Usi dell’acetato di calcio
Ca(C2H3O2)2 ha numerose applicazioni in vari campi. Ecco alcuni usi comuni di Ca(C2H3O2)2:
- Additivo alimentare: utilizzato come additivo alimentare, soprattutto nei prodotti da forno, per migliorare la consistenza e prolungare la durata di conservazione.
- Applicazioni medicinali: utilizzato come medicinale per il trattamento di livelli elevati di fosfato nel sangue in pazienti con malattia renale cronica. Agisce legandosi al fosfato presente negli alimenti e impedendone l’assorbimento da parte dell’organismo.
- Trattamento dell’acqua: utilizzato nel trattamento dell’acqua per ridurre i livelli di piombo e altri metalli pesanti.
- Reagente di laboratorio: utilizzato come reagente nei laboratori per varie reazioni chimiche.
- Agente antifungino: utilizzato anche come agente antifungino nel trattamento di alcune infezioni della pelle.
- Acceleratore del calcestruzzo: utilizzato come acceleratore del calcestruzzo, che aiuta ad accelerare il processo di presa del calcestruzzo.
- Ritardante di fiamma: utilizzato come ritardante di fiamma in vari materiali tra cui plastica e tessuti.
Domande:
D: L’acetato di calcio è acido, basico o neutro?
R: Ca(C2H3O2)2 è un composto basico.
D: L’acetato di calcio è solubile in acqua?
R: Sì, Ca(C2H3O2)2 è solubile in acqua.
D: Come produrre l’acetato di calcio?
R: Il Ca(C2H3O2)2 può essere prodotto con vari metodi, inclusa la reazione del carbonato di calcio o dell’idrossido di calcio con l’acido acetico. La miscela risultante viene quindi filtrata e il filtrato viene lasciato raffreddare e cristallizzare, formando Ca(C2H3O2)2.
D: Dove acquistare acetato di calcio?
R: Il Ca(C2H3O2)2 può essere acquistato presso fornitori di prodotti chimici, negozi di forniture per laboratorio e rivenditori online.
D: L’acetato di calcio è ionico o covalente?
R: Ca(C2H3O2)2 è un composto ionico composto da cationi calcio e anioni acetato tenuti insieme da legami ionici.
