L’acetato di sodio (C2H3NaO2) è un composto composto da ioni Na+ e C2H3O2-. È comunemente usato come additivo alimentare e in applicazioni mediche, come nelle soluzioni di dialisi, e come fonte di carbonio per alcuni batteri.
| Nome IUPAC | Acetato di sodio |
| Formula molecolare | C2H3NaO2 |
| numero CAS | 127-09-3 |
| Sinonimi | Sale sodico dell’acido acetico, etanoato di sodio, Natriumacetat |
| InChI | InChI=1S/C2H4O2.Na/c1-2(3)4;/h1H3,(H,3,4);/q;+1/p-1 |
Proprietà dell’acetato di sodio
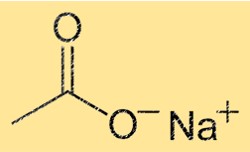
Formula di acetato di sodio
La formula chimica dell’acetato di sodio è NaC2H3O2. Ciò indica che il composto è composto da uno ione Na+ e uno ione C2H3O2-. Lo ione C2H3O2- è composto da un atomo di carbonio, due atomi di ossigeno e tre atomi di idrogeno. La formula è utile per determinare la stechiometria delle reazioni chimiche e per prevedere il comportamento del composto in diverse condizioni.
Massa molare dell’acetato di sodio
NaC2H3O2 ha una massa molare di 82,03 g/mol. Ciò significa che una mole di NaC2H3O2 pesa 82,03 grammi. La massa molare si calcola sommando le masse atomiche di ciascun elemento presente nel composto. Il sodio ha una massa di 22,99 g/mol, il carbonio ha una massa di 12,01 g/mol, l’idrogeno ha una massa di 1,01 g/mol e l’ossigeno ha una massa di 16,00 g/mol. La massa molare di NaC2H3O2 è utile per determinare la quantità di composto presente in un dato campione.
Punto di ebollizione dell’acetato di sodio
NaC2H3O2 ha un punto di ebollizione di 881°C (1.618°F). Il punto di ebollizione è la temperatura alla quale una sostanza passa dallo stato liquido a quello gassoso. L’alto punto di ebollizione di NaC2H3O2 è dovuto ai forti legami ionici tra gli ioni sodio e acetato. A temperature elevate, questi legami si rompono e il composto vaporizza.
Acetato di sodio Punto di fusione
NaC2H3O2 ha un punto di fusione di 324°C (615°F). Il punto di fusione è la temperatura alla quale una sostanza passa dallo stato solido a quello liquido. L’alto punto di fusione di NaC2H3O2 è dovuto anche ai forti legami ionici tra gli ioni sodio e acetato. Alle alte temperature questi legami si indeboliscono e il composto si scioglie.
Densità dell’acetato di sodio g/mL
NaC2H3O2 ha una densità di 1,45 g/mL. La densità è la quantità di massa per unità di volume di una sostanza. L’elevata densità di NaC2H3O2 è dovuta alla disposizione compatta delle sue molecole. La densità di NaC2H3O2 può variare a seconda della sua concentrazione in una soluzione.
Peso molecolare dell’acetato di sodio
Il peso molecolare di NaC2H3O2 è 82,03 g/mol. È la massa di una mole del composto. Il peso molecolare è utile per determinare la quantità di un composto in un dato campione, nonché per calcolare la stechiometria delle reazioni chimiche.
Struttura dell’acetato di sodio
NaC2H3O2 ha una struttura cristallina con un’unità ripetitiva Na(CH3COO). Ciò significa che ciascuna cella unitaria del cristallo contiene uno ione sodio e uno ione acetato. Lo ione Na+ è circondato da sei atomi di ossigeno, mentre lo ione C2H3O2- è composto da un atomo di carbonio, due atomi di ossigeno e tre atomi di idrogeno. I forti legami ionici tra gli ioni conferiscono al cristallo la sua stabilità e i suoi elevati punti di fusione e di ebollizione.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 1,45 a 20°C |
| Colore | Incolore o bianco |
| Odore | Inodore |
| Massa molare | 82,03 g/mole |
| Densità | 1,45 g/cm³ a 20°C |
| Punto di fusione | 324°C (615°F) |
| Punto di ebollizione | 881°C (1618°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | 820 g/l (20°C) |
| Solubilità | Solubile in acqua, etanolo, acetone |
| Pressione del vapore | 1 mmHg a 239,2°C |
| Densità del vapore | Non applicabile |
| pKa | 4,76 (a 25°C) |
| pH | 7 (soluzione all’1%) |
Sicurezza e pericoli dell’acetato di sodio
NaC2H3O2 è generalmente considerato sicuro da maneggiare e utilizzare quando vengono prese le dovute precauzioni. Tuttavia, può causare irritazione alla pelle e agli occhi e l’ingestione o l’inalazione di grandi quantità può causare irritazione gastrointestinale, problemi respiratori e depressione del sistema nervoso centrale. NaC2H3O2 può anche reagire con forti agenti ossidanti, acidi e alcali, generando calore e gas pericolosi. È importante indossare dispositivi di protezione individuale adeguati durante la manipolazione di NaC2H3O2, compresi guanti e protezione per gli occhi. NaC2H3O2 deve essere conservato in un’area fresca, asciutta e ben ventilata, lontano da sostanze incompatibili. In caso di esposizione o ingestione accidentale, consultare immediatamente un medico.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | Evitare il contatto con la pelle e gli occhi. Non ingerire o inalare. Utilizzare in aree ben ventilate. |
| Numeri di identificazione delle Nazioni Unite | Non regolato |
| Codice SA | 2915.21.00 |
| Classe di pericolo | Non classificato |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | Bassa tossicità |
Metodi per la sintesi dell’acetato di sodio
Esistono diversi metodi per sintetizzare NaC2H3O2, ma il più comune prevede la reazione di neutralizzazione dell’acido acetico e dell’idrossido di sodio . L’equazione di reazione è la seguente:
CH3COOH + NaOH → CH3COONa + H2O
Per effettuare la reazione, viene prima preparata una soluzione di acido acetico sciogliendo l’acido acetico glaciale in acqua. Mescolando, aggiungere lentamente idrossido di sodio alla soluzione di acido acetico fino a quando il pH della soluzione raggiunge circa 7.
A questo punto la soluzione conterrà NaC2H3O2 e acqua. Per ottenere NaC2H3O2 solido, la soluzione può essere evaporata a fuoco basso finché non si asciuga. In alternativa, è possibile lasciare raffreddare la soluzione a temperatura ambiente e i cristalli di NaC2H3O2 precipiteranno da soli.
Un altro metodo per sintetizzare NaC2H3O2 prevede la reazione tra anidride acetica e carbonato di sodio . L’equazione di reazione è la seguente:
2 (CH3CO)2O + Na2CO3 → 2 CH3COONa + CO2 + CO + H2O
Questa reazione produce NaC2H3O2, anidride carbonica, monossido di carbonio e acqua.
L’evaporazione della miscela di reazione a secchezza e poi la sua cristallizzazione in acqua può dare NaC2H3O2 in forma solida. L’alto costo dell’anidride acetica rende questo metodo poco utilizzato.
Usi dell’acetato di sodio
NaC2H3O2 è una sostanza chimica versatile con molte applicazioni industriali e scientifiche. Ecco alcuni dei suoi usi comuni:
- Agente tampone: comunemente utilizzato come agente tampone in applicazioni chimiche e biologiche. Aiuta a mantenere un pH stabile e a prevenire le fluttuazioni di acidità.
- Pacchetti riscaldanti: utilizzati nella produzione di pacchetti riscaldanti o cuscinetti riscaldanti. Queste borse sono piccole e possono riscaldarsi per fornire calore a una zona specifica del corpo.
- Additivo alimentare: utilizzato come additivo alimentare, principalmente come esaltatore di sapidità, regolatore di pH e conservante. I produttori di alimenti trasformati solitamente lo includono in snack, salse e prodotti a base di carne.
- Industria tessile: utilizzato nell’industria tessile come coadiuvante nella tintura e nella stampa. Aiuta a migliorare l’assorbimento del colorante e la solidità del colore dei tessuti.
- Sintesi chimica: utilizzato come reagente in varie reazioni chimiche. Converte gli alcoli nei corrispondenti alogenuri alchilici e produce anidride acetica dall’acido acetico.
- Applicazioni mediche: utilizzato in applicazioni mediche come l’emodialisi e come componente di soluzioni elettrolitiche.
- Fotografia: utilizzato in fotografia come soluzione fissativa per rimuovere gli alogenuri d’argento non esposti da stampe fotografiche e negativi.
Domande:
D: Qual è lo scopo dell’acetato di sodio nella sintesi dell’ammide?
R: NaC2H3O2 viene utilizzato nella sintesi dell’ammide come base per deprotonare il gruppo amminico del materiale di partenza. Ciò facilita la reazione con l’acido carbossilico per formare il legame ammidico.
D: Qual è lo scopo della soluzione di acetato di sodio nella sintesi dell’ammide?
R: La soluzione NaC2H3O2 viene utilizzata come catalizzatore basico nella sintesi dell’ammide. Aiuta a deprotonare il gruppo amminico del materiale di partenza, rendendolo più reattivo verso l’acido carbossilico.
D: È a base di acetato di sodio?
R: Sì, NaC2H3O2 è una base. È la base coniugata dell’acido acetico e ha un pH intorno a 9 quando disciolto in acqua.
D: Cos’è l’acetato di sodio?
R: NaC2H3O2 è un sale sodico dell’acido acetico, con la formula chimica NaCH3COO. È una polvere bianca, inodore e cristallina, solubile in acqua.
D: Qual è lo scopo della soluzione di acetato di sodio nella sintesi dell’acetofenetidina ammide?
R: Nella sintesi ammidica dell’acetofenetidina, la soluzione NaC2H3O2 viene utilizzata come catalizzatore di base per facilitare la reazione tra p-fenetidina e anidride acetica. Aiuta a deprotonare il gruppo amminico della p-fenetidina e ad attivarlo verso l’attacco nucleofilo da parte dell’anidride acetica. Ciò provoca la formazione di acetofenetidina.
