Il fosfato di magnesio (Mg3(PO4)2) è un composto composto da ioni magnesio e fosfato. Svolge un ruolo vitale in molti processi biologici come la sintesi del DNA, la funzione nervosa e la contrazione muscolare.
| Nome IUPAC | Fosfato di magnesio |
| Formula molecolare | Mg3(PO4)2 |
| numero CAS | 7757-87-1 |
| Sinonimi | Fosfato di trimagnesio, ortofosfato di trimagnesio, ortofosfato di magnesio, fosfato terziario di magnesio, fosfato di magnesio tribasico |
| InChI | InChI=1S/2Mg.3H3O4P/c;;3 1-5(2,3)4/h;;3 (H3,1,2,3,4)/q2*+2;;;/p-6 |
Proprietà del fosfato di magnesio
Formula di fosfato di magnesio
La formula chimica del fosfato di magnesio è Mg3(PO4)2, che indica che contiene tre ioni Mg+2 e due ioni PO43-. La formula è essenziale nei calcoli stechiometrici e aiuta a determinare la quantità corretta di reagenti e prodotti nelle reazioni chimiche che coinvolgono Mg3(PO4)2.
Massa molare del fosfato di magnesio
Mg3(PO4)2 ha una massa molare di 262,86 g/mol. Questo valore rappresenta la massa di una mole del composto Mg3(PO4)2, che è una combinazione di tre ioni Mg+2 e due ioni PO4-. La massa molare è una proprietà cruciale utilizzata nei calcoli stechiometrici per determinare la quantità di Mg3(PO4)2 necessaria in varie reazioni chimiche.
Punto di ebollizione del fosfato di magnesio
Il Mg3(PO4)2 non ha un punto di ebollizione definito poiché si decompone prima di raggiungere il punto di ebollizione. Ad alte temperature, Mg3(PO4)2 si decompone in ossido di magnesio e pentossido di fosforo, che hanno punti di ebollizione rispettivamente di 3.600°C e 300°C. La temperatura di decomposizione del Mg3(PO4)2 dipende da vari fattori quali concentrazione, velocità di riscaldamento e pressione.
Punto di fusione del fosfato di magnesio
Mg3(PO4)2 ha un punto di fusione di 1188°C. A questa temperatura il composto subisce un cambiamento di fase dallo stato solido a quello liquido. Il punto di fusione di Mg3(PO4)2 è influenzato da vari fattori, tra cui pressione, impurità e struttura cristallina.
Densità del fosfato di magnesio g/mL
La densità di Mg3(PO4)2 varia a seconda della struttura cristallina e delle condizioni in cui viene misurata. La forma più comune di Mg3(PO4)2, tri-Mg3(PO4)2, ha una densità di 2,195 g/mL. Il valore della densità è essenziale per determinare la massa di Mg3(PO4)2 necessaria per ottenere un volume specifico in varie applicazioni.
Peso molecolare del fosfato di magnesio
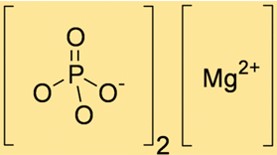
Mg3(PO4)2 ha un peso molecolare di 262,86 g/mol. Questo valore viene calcolato sommando i pesi atomici degli ioni Mg e PO43- presenti nel composto. Il peso molecolare di Mg3(PO4)2 è utile per determinare la quantità di Mg3(PO4)2 necessaria in varie reazioni chimiche.
Struttura del fosfato di magnesio
Mg3(PO4)2 ha una struttura cristallina che varia a seconda del metodo e delle condizioni di preparazione. La forma più comune è il tri-Mg3(PO4)2, che ha una struttura cristallina composta da ioni Mg+2 e ioni PO43- disposti in un reticolo esagonale. La struttura cristallina influenza le proprietà fisiche e chimiche di Mg3(PO4)2.
| Aspetto | Polvere cristallina bianca |
| Peso specifico | 2.195 |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 262,86 g/mole |
| Densità | 2.195 g/ml |
| Punto di fusione | 1188°C |
| Punto di ebollizione | Si decompone prima del punto di ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | Insolubile |
| Solubilità | Solubile negli acidi |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | 7.2 |
| pH | 8-9 (soluzione al 10%) |
Sicurezza e pericoli del fosfato di magnesio
Il Mg3(PO4)2 è generalmente considerato sicuro e non tossico. Non è classificato come materiale pericoloso e non presenta rischi significativi per la salute umana o per l’ambiente. Tuttavia, l’esposizione prolungata ad alte concentrazioni di polvere di Mg3(PO4)2 può causare irritazione respiratoria. L’ingestione di grandi quantità di Mg3(PO4)2 può causare irritazione gastrointestinale e nausea. È importante maneggiare Mg3(PO4)2 con cura e indossare dispositivi di protezione individuale adeguati quando si maneggiano grandi quantità di composto. Eventuali fuoriuscite o perdite devono essere prontamente ripulite per evitare qualsiasi rischio di scivolamento o caduta.
| Simboli di pericolo | Nessuno |
| Descrizione della sicurezza | Non classificato come pericoloso |
| Numeri di identificazione delle Nazioni Unite | Non applicabile |
| Codice SA | 2835.29.10 |
| Classe di pericolo | Non classificato |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | Non tossico a concentrazioni normali |
Metodi di sintesi del fosfato di magnesio
Diversi metodi possono sintetizzare Mg3(PO4)2, tra cui la precipitazione, la reazione dell’ossido di magnesio con acido fosforico e la reazione dell’idrossido di magnesio con acido fosforico.
Il processo di precipitazione prevede l’aggiunta di un sale fosfato solubile, come Na3PO4, a una soluzione contenente un sale solubile di Mg+2, come MgCl2 o solfato di magnesio. Successivamente, la miscelazione delle due soluzioni produce un precipitato di Mg3(PO4)2 che può essere raccolto ed essiccato.
La reazione prevede l’aggiunta di ossido di magnesio ad una soluzione di acido fosforico e il riscaldamento della miscela per portare a completamento la reazione. Il processo quindi raccoglie e lava il Mg3(PO4)2 risultante per rimuovere eventuali impurità.
La reazione prevede l’aggiunta di idrossido di magnesio ad una soluzione di acido fosforico e il riscaldamento della miscela per portarla a completamento. Raccogliere quindi il Mg3(PO4)2 risultante e lavarlo accuratamente per rimuovere tutte le impurità.
A seconda della qualità delle materie prime e delle condizioni di reazione, questi metodi possono essere utilizzati per produrre Mg3(PO4)2 con diversi gradi di purezza.
Usi del fosfato di magnesio
Mg3(PO4)2 ha diversi usi in vari settori, tra cui:
- Industria alimentare: utilizzato come additivo alimentare per regolare i livelli di acidità e migliorare la consistenza e la qualità di prodotti da forno, latticini e bevande.
- Agricoltura: utilizzato come fertilizzante per fornire alle piante nutrienti essenziali come magnesio e fosforo.
- Industria farmaceutica: utilizzato come ingrediente attivo in antiacidi e lassativi per aiutare ad alleviare i sintomi di indigestione e stitichezza.
- Trattamento dell’acqua: utilizzato come prodotto chimico per il trattamento dell’acqua per controllare la formazione di calcare nelle caldaie e nei tubi e per prevenire la corrosione.
- Industria ceramica: utilizzato come legante ceramico per migliorare la resistenza e la durata dei prodotti ceramici.
- Ignifugo: utilizzato come ritardante di fiamma nei materiali da costruzione come isolanti, cartongesso e rivestimenti.
- Cosmetici: utilizzato nei cosmetici e nei prodotti per la cura personale come addensante ed emulsionante.
Domande:
D: Qual è la formula corretta per il composto formato tra gli ioni Mg+2 e PO43-?
R: La formula corretta per il composto formato tra gli ioni Mg+2 e gli ioni PO43- è Mg3(PO4)2.
D: Qual è la formula del fosfato di magnesio?
R: La formula del fosfato di magnesio è Mg3(PO4)2.
D: Quanti ioni compongono un’unità della formula di fosfato di magnesio?
R: Un’unità della formula di Mg3(PO4)2 contiene 11 ioni: tre ioni Mg+2 e due ioni PO43-.
D: Il fosfato di magnesio è solubile?
R: Mg3(PO4)2 ha una bassa solubilità in acqua, con una solubilità di circa 0,1 g/100 ml a temperatura ambiente.
D: Un acido (x) reagisce con una base (y) per produrre Mg3(PO4)2. Cosa sono x e y?
R: L’acido (x) è acido fosforico (H3PO4) e la base (y) è idrossido di magnesio (Mg(OH)2).
D: Qual è la massa molare di Mg3(PO4)2, una sostanza precedentemente utilizzata in medicina come antiacido?
R: La massa molare di Mg3(PO4)2 è 262,86 g/mol.
D: Il Mg3(PO4)2 è solubile in acqua?
R: Mg3(PO4)2 ha una bassa solubilità in acqua, con una solubilità di circa 0,1 g/100 ml a temperatura ambiente.
D: Quante moli di atomi di ossigeno ci sono in una mole di Mg3(PO4)2?
R: Una mole di Mg3(PO4)2 contiene 8 moli di atomi di ossigeno.
