Il fosfato di calcio (Ca3(PO4)2) è un minerale presente nei denti e nelle ossa. Questo aiuta a renderli forti e sani. Viene anche utilizzato come integratore alimentare per prevenire la carenza di calcio.
| Nome IUPAC | Fosfato di calcio |
| Formula molecolare | Ca3(PO4)2 |
| numero CAS | 7758-87-4 |
| Sinonimi | Fosfato tricalcico, fosfato osseo, ortofosfato di calcio, fosfato di calcio tribasico, TCP |
| InChI | InChI=1S/3Ca.2H3O4P/c;;;2 1-5(2,3)4/h;;;2 (H3,1,2,3,4)/q3*+2;;/p-6 |
Proprietà del fosfato di calcio
Formula del fosfato di calcio
La formula chimica del fosfato di calcio è Ca3(PO4)2, che indica che contiene tre ioni calcio e due ioni fosfato. La formula viene utilizzata per calcolare la quantità di fosfato di calcio necessaria per le reazioni chimiche. Il fosfato di calcio è un componente importante di denti e ossa e viene utilizzato anche in varie applicazioni industriali, come additivi alimentari e fertilizzanti.
Massa molare del fosfato di calcio
La massa molare di Ca3(PO4)2 è 310,18 g/mol. Si calcola aggiungendo la massa atomica di calcio, fosforo e ossigeno, che sono rispettivamente 40,08 g/mol, 30,97 g/mol e 15,99 g/mol. La massa molare è un parametro importante per determinare la quantità di Ca3(PO4)2 necessaria in una reazione chimica.
Punto di ebollizione del fosfato di calcio
Ca3(PO4)2 non ha un punto di ebollizione definito perché si decompone prima di raggiungere il punto di ebollizione. Quando riscaldato, Ca3(PO4)2 si decompone in ossido di calcio e pentossido di fosforo, rilasciando vapore acqueo. La temperatura di decomposizione dipende dal tipo di Ca3(PO4)2 e dalla velocità di riscaldamento.
Punto di fusione del fosfato di calcio
Il punto di fusione di Ca3(PO4)2 dipende dal tipo di Ca3(PO4)2. Il punto di fusione del fosfato tricalcico, la forma più abbondante di Ca3(PO4)2 in natura, è circa 1670°C. Il fosfato bicalcico ha un punto di fusione di circa 1400°C, mentre il fosfato monocalcico fonde a circa 109°C.
Densità del fosfato di calcio g/mL
La densità di Ca3(PO4)2 varia a seconda del tipo di Ca3(PO4)2. Il fosfato tricalcico ha una densità di circa 3,14 g/ml, mentre il fosfato bicalcico ha una densità di circa 2,31 g/ml. Il fosfato monocalcico ha una densità di circa 2,22 g/mL.
Peso molecolare del fosfato di calcio
Il peso molecolare di Ca3(PO4)2 è 310,18 g/mol, che corrisponde alla somma dei pesi atomici di calcio, fosforo e ossigeno. Il peso molecolare è importante per calcolare la quantità di Ca3(PO4)2 necessaria per le reazioni chimiche.
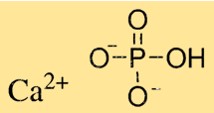
Struttura del fosfato di calcio
Ca3(PO4)2 ha una struttura cristallina complessa che dipende dal tipo di Ca3(PO4)2. Il fosfato tricalcico ha una struttura cristallina esagonale, mentre il fosfato bicalcico ha una struttura cristallina monoclina. Il fosfato monocalcico ha una struttura cristallina tetragonale. I cristalli di Ca3(PO4)2 sono composti da ioni calcio e ioni fosfato disposti secondo uno schema specifico.
| Aspetto | Polvere bianca o cristalli |
| Peso specifico | 3.14 |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 310,18 g/mole |
| Densità | 3,14 g/ml (fosfato tricalcico) |
| Punto di fusione | 1670 °C (fosfato tricalcico) |
| Punto di ebollizione | Si rompe prima dell’ebollizione |
| Punto flash | N / A |
| solubilità in acqua | 0,002 g/100 ml (a 25°C) |
| Solubilità | Solubile negli acidi, insolubile in acqua |
| Pressione del vapore | N / A |
| Densità del vapore | N / A |
| pKa | pKa1: 1,9, pKa2: 6,7, pKa3: 12,0 |
| pH | 5,5-7,5 (sospensione al 10% in acqua) |
Sicurezza e pericoli del fosfato di calcio
Il Ca3(PO4)2 è generalmente considerato sicuro per il consumo umano e non presenta rischi significativi per la salute. È un minerale naturale presente nelle ossa e nei denti e utilizzato come integratore alimentare in molte forme. Ca3(PO4)2 viene utilizzato anche nell’industria alimentare come additivo alimentare e condizionatore per impasti. Tuttavia, un consumo eccessivo di integratori di Ca3(PO4)2 può portare a effetti avversi, come disturbi di stomaco, costipazione e persino danni ai reni. Inoltre, l’esposizione a livelli elevati di polvere di Ca3(PO4)2 sul posto di lavoro può causare problemi respiratori. Pertanto, è importante utilizzare integratori e prodotti a base di Ca3(PO4)2 con moderazione e seguire le linee guida sulla sicurezza industriale.
| Simboli di pericolo | Nessuno conosciuto |
| Descrizione della sicurezza | 26-36/37/39: Indossare indumenti protettivi, guanti e proteggersi gli occhi/il viso adeguati. |
| Numeri di identificazione delle Nazioni Unite | N / A |
| Codice SA | 28352500 |
| Classe di pericolo | Non classificato |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | Bassa tossicità |
Metodi di sintesi del fosfato di calcio
Esistono diversi metodi per la sintesi di Ca3(PO4)2, tra cui la precipitazione, la sintesi idrotermale, il processo sol-gel e la reazione allo stato solido.
Il metodo di precipitazione prevede la combinazione di ioni calcio e fosfato in una soluzione acquosa, con conseguente formazione di un precipitato attraverso una reazione chimica. Lo sperimentatore quindi lava ed asciuga il precipitato per ottenere il composto Ca3(PO4)2 desiderato.
La sintesi idrotermale prevede la reazione di fonti di calcio e fosfato in un ambiente ad alta pressione e alta temperatura. Per ottenere il composto Ca3(PO4)2 desiderato, il prodotto risultante viene lavato ed essiccato.
Nel processo sol-gel, un sol, o sospensione colloidale, viene convertito in un gel e quindi essiccato per ottenere il composto Ca3(PO4)2 desiderato. Questo metodo consente un controllo preciso della composizione e della morfologia del composto ottenuto.
La reazione allo stato solido prevede la miscelazione di pirofosfato di calcio e carbonato di calcio allo stato solido e quindi il riscaldamento della miscela per favorire una reazione chimica. Per ottenere il composto Ca3(PO4)2 desiderato, il prodotto ottenuto deve essere lavato e asciugato.
Usi del fosfato di calcio
Ca3(PO4)2 ha molti usi in diversi settori grazie alle sue proprietà uniche. Alcuni degli usi comuni di Ca3(PO4)2 sono:
- Integratori alimentari: comunemente utilizzati negli integratori alimentari come fonte di calcio e fosforo, minerali essenziali per la salute delle ossa.
- Industria alimentare e delle bevande: utilizzato come additivo alimentare in molti alimenti trasformati, compresi prodotti da forno, latticini e bevande. Nella cottura al forno, le persone lo usano come agente lievitante e fonte di calcio.
- Industria farmaceutica: utilizzato nell’industria farmaceutica come riempitivo e legante in compresse e capsule. È possibile migliorare la biodisponibilità di alcuni farmaci utilizzandoli come agente di rivestimento.
- Agricoltura: utilizzato come fertilizzante per fornire alle piante nutrienti essenziali come calcio e fosforo.
- Odontoiatria: utilizzato in odontoiatria per rimineralizzare i denti e ripristinare lo smalto dei denti.
- Ingegneria biomedica: utilizzato anche nell’ingegneria biomedica per sviluppare sostituti dell’innesto osseo e migliorare le proprietà dei biomateriali utilizzati nell’ingegneria del tessuto osseo.
Domande:
D: Perché l’aggiunta di acido aumenta la solubilità del fosfato di calcio?
R: L’aggiunta di acido aumenta la solubilità di Ca3(PO4)2 protonando gli ioni fosfato, rendendoli più solubili in acqua. Gli ioni fosfato protonati formano Ca3(PO4)2 acido, che è più solubile della forma neutra.
D: Quanti grammi di fosforo ci sono in 500,0 grammi di fosfato di calcio?
R: La massa molare di Ca3(PO4)2 è 310,18 g/mol. Il composto ha un rapporto fosforo/calcio di 2:3, quindi la massa molare del fosforo è 30,97 g/mol. In 500,0 grammi di Ca3(PO4)2 ci sono quindi 81,62 grammi di fosforo.
D: Il fosfato di calcio è solubile?
R: Ca3(PO4)2 ha una bassa solubilità in acqua, con una solubilità del prodotto di 1,8 x 10^-29. Tuttavia, la sua solubilità può essere aumentata mediante l’aggiunta di acidi.
D: Qual è la percentuale di ossigeno, in massa, nel fosfato di calcio?
R: La massa molare di Ca3(PO4)2 è 310,18 g/mol. La massa atomica dell’ossigeno è 16,00 g/mol e in una mole di Ca3(PO4)2 sono presenti 8 atomi di ossigeno. Pertanto, la massa di ossigeno in una mole di Ca3(PO4)2 è 8 x 16,00 = 128,00 g. La massa di Ca3(PO4)2 è 310,18 g, quindi la percentuale di ossigeno, in massa, è (128,00 g / 310,18 g) x 100% = 41,23%.
D: Il Ca3(PO4)2 è solubile in acqua?
R: Ca3(PO4)2 non è molto solubile in acqua, con una solubilità del prodotto di 1,3 x 10^-33.
D: Qual è la massa molare di Ca3(PO4)2?
R: La massa molare di Ca3(PO4)2 è 310,18 g/mol.
D: Cos’è Ca3(PO4)2?
R: Ca3(PO4)2 è un composto chimico composto da tre ioni Ca2+ e due ioni PO43-. È una polvere bianca, inodore e insolubile in acqua.
D: Qual è la massa formula in grammi di Ca3(PO4)2?
R: La massa formula in grammi di Ca3(PO4)2 è 310,18 g/mol.
