Lo ioduro di magnesio è un composto chimico con la formula MgI2. È un solido cristallino bianco altamente solubile in acqua e alcool. MgI2 è comunemente usato come fonte di iodio nelle reazioni di sintesi organica.
| Nome dell’IUPAC | Ioduro di magnesio |
| Formula molecolare | MgI2 |
| numero CAS | 10377-58-9 |
| Sinonimi | Diioduro di magnesio, Ioduro di magnesio(II), UNII-14R347R70C |
| InChI | InChI=1S/2HI.Mg/h2*1H;/q;;+2/p-2 |
Proprietà dello ioduro di magnesio
Formula dello ioduro di magnesio
La formula chimica dello ioduro di magnesio è MgI2. Questa formula indica che una molecola di ioduro di magnesio è costituita da un catione Mg2+ e due anioni I-. La formula dello ioduro di magnesio è utile per determinare la stechiometria delle reazioni chimiche e prevedere i prodotti delle reazioni chimiche che coinvolgono il composto.
Massa molare dello ioduro di magnesio
MgI2 ha una massa molare di 278.113 g/mol. Questo valore si ottiene sommando la massa atomica di un atomo di Mg (24,305 g/mol) alla massa atomica di due atomi di I (253,808 g/mol) presenti in una molecola di MgI2. La massa molare di MgI2 è un parametro importante per determinare la massa di una determinata quantità del composto, utile in molte applicazioni industriali e scientifiche.
Punto di ebollizione dello ioduro di magnesio
MgI2 ha un punto di ebollizione relativamente alto di 1309°C. Ciò indica che è necessaria una notevole quantità di energia per rompere le forze di attrazione intermolecolari tra gli atomi di Mg e I nel composto. Il punto di ebollizione di MgI2 lo rende adatto per applicazioni ad alta temperatura, come nella produzione di semiconduttori e altri componenti elettronici.
Punto di fusione dello ioduro di magnesio
Il punto di fusione di MgI2 è 637°C. A questa temperatura l’MgI2 solido si trasforma nello stato liquido. Il punto di fusione di MgI2 è un’importante proprietà fisica che ne determina l’idoneità per varie applicazioni. Ad esempio, l’elevato punto di fusione rende MgI2 ideale per l’utilizzo come fondente nella produzione di leghe di alluminio, dove è necessario fondere insieme i metalli per creare una miscela omogenea.
Densità dello ioduro di magnesio g/mL
La densità di MgI2 è 4,43 g/mL. Questo valore indica la massa del composto presente in un dato volume di spazio. La densità di MgI2 è un fattore importante da considerare quando si determina la quantità di composto richiesta per una particolare applicazione. L’elevata densità di MgI2 lo rende utile anche come materiale schermante nei reattori nucleari.
Peso molecolare dello ioduro di magnesio
Il peso molecolare di MgI2 è 278,113 g/mol. Questo valore è la somma dei pesi atomici degli elementi costitutivi del composto, Mg e I. Il peso molecolare di MgI2 è utile per calcolare la stechiometria delle reazioni chimiche e determinare il numero di moli del composto presente in un dato campione.
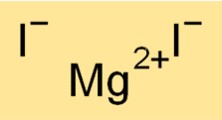
Struttura dello ioduro di magnesio
MgI2 ha una struttura cristallina che appartiene al sistema cristallino esagonale. La struttura è costituita da cationi magnesio e anioni ioduro disposti in un reticolo esagonale. I cationi Mg2+ occupano il centro delle celle esagonali, mentre gli anioni I- occupano gli angoli delle celle. La struttura cristallina di MgI2 contribuisce alle sue proprietà fisiche e chimiche, come i suoi elevati punti di fusione e di ebollizione.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 4,43 g/ml |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 278,113 g/mole |
| Densità | 4,43 g/ml |
| Punto di fusione | 637°C |
| Punto di ebollizione | 1.309°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Solubile |
| Solubilità | Solubile in alcool, acetone |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | Non applicabile |
Sicurezza e pericoli dello ioduro di magnesio
MgI2 è generalmente considerato sicuro se maneggiato e utilizzato correttamente. Tuttavia, come qualsiasi composto chimico, può presentare alcuni pericoli se non maneggiato con attenzione. L’MgI2 è classificato come irritante per la pelle e gli occhi e l’esposizione prolungata al composto può causare sensibilizzazione cutanea o irritazione respiratoria. È importante utilizzare dispositivi di protezione individuale adeguati durante la manipolazione di MgI2, inclusi guanti, protezione per gli occhi e un respiratore se necessario. Inoltre, MgI2 può reagire violentemente con l’acqua, rilasciando gas idrogeno infiammabile. Deve quindi essere immagazzinato e maneggiato lontano da fonti di umidità.
| Simboli di pericolo | Xi: Irritante |
| Descrizione della sicurezza | S22: Non respirare le polveri. S24: Evitare il contatto con la pelle. S36/37/39: Indossare indumenti protettivi, guanti e proteggersi gli occhi/il viso adeguati. |
| Numeri di identificazione delle Nazioni Unite | UN3077 |
| Codice SA | 28276000 |
| Classe di pericolo | 9: Merci pericolose varie |
| Gruppo di imballaggio | III |
| Tossicità | Bassa tossicità |
Metodi di sintesi dello ioduro di magnesio
Esistono diversi metodi per sintetizzare MgI2, ciascuno con i suoi vantaggi e limiti.
Un metodo comune prevede la reazione del magnesio metallico con lo iodio in un solvente etere anidro o tetraidrofurano (THF). Questa reazione produce MgI2 sotto forma di un precipitato solido bianco.
Un altro metodo prevede la reazione dell’ossido di magnesio o dell’idrossido di magnesio con l’acido idriodico. Questo metodo generalmente prevede il riscaldamento dell’ossido o dell’idrossido di magnesio con acido idroiodico per produrre MgI2.
Anche la reazione del carbonato di magnesio o dell’ossido di magnesio con il gas di acido iodidrico produce MgI2. Questa reazione avviene generalmente a temperature elevate e produce MgI2 come prodotto solido bianco.
Nel complesso, la scelta del metodo di sintesi dell’MgI2 dipenderà da fattori quali la purezza desiderata del prodotto finale, la disponibilità delle materie prime e le condizioni in cui verrà effettuata la sintesi.
Usi dello ioduro di magnesio
MgI2 ha molti usi in diversi campi grazie alle sue proprietà uniche. Ecco alcune applicazioni comuni di MgI2:
- Come catalizzatore: utilizzato come catalizzatore nelle reazioni chimiche organiche, in particolare nella formazione di legami carbonio-carbonio.
- Nella preparazione dei reagenti di Grignard: Utilizzato nella preparazione dei reagenti di Grignard. I chimici organici utilizzano i reagenti di Grignard per sintetizzare un’ampia gamma di composti organici.
- In medicina: usato in medicina come integratore per fornire al corpo magnesio e iodio essenziali, importanti per il mantenimento di funzioni corporee sane.
- Nei reattori nucleari: utilizzato nei reattori nucleari come assorbitore di neutroni per controllare la velocità delle reazioni di fissione.
- Elaborazione fotografica: utilizzato nell’elaborazione fotografica come agente stabilizzante per prevenire l’ossidazione e il degrado delle pellicole fotografiche.
- Nella produzione del magnesio metallico: utilizzato anche come precursore nella produzione del magnesio metallico, che ha un’ampia gamma di applicazioni in diversi settori.
Domande:
D: Che tipo di dissoluzione subirebbe MgI2?
R: MgI2 subirebbe una dissoluzione ionica a causa della sua natura di composto ionico.
D: Qual è la formula chimica dello ioduro di magnesio?
R: La formula chimica dello ioduro di magnesio è MgI2.
D: MgI2 è solubile?
R: Sì, MgI2 è solubile in acqua, alcool ed etere.
D: Qual è la formula dello ioduro di magnesio?
R: La formula dello ioduro di magnesio è MgI2.
D: Che tipo di composto è MgI2?
R: MgI2 è un composto ionico, formato dal trasferimento di due elettroni dal magnesio allo iodio.
D: Quale composto ha la formula chimica MgI2?
R: Il composto con la formula chimica MgI2 è ioduro di magnesio.
D: Qual è il nome del composto con la formula MgI2?
R: Il nome del composto con la formula MgI2 è ioduro di magnesio.
