Il bromuro di potassio (KBr) è un composto chimico composto da potassio e bromo. È comunemente usato in fotografia, medicina e veterinaria come anticonvulsivante per cani.
| Nome IUPAC | Bromuro di potassio |
| Formula molecolare | KBr |
| numero CAS | 7758-02-3 |
| Sinonimi | Bromuro di potassio, Sale di bromuro di potassio, Kaliobromuro, Bromopotassio |
| InChI | InChI=1S/BrH.K/h1H;/q;+1/p-1 |
Proprietà del bromuro di potassio
Formula di bromuro di potassio
La formula chimica del bromuro di potassio è KBr. Questa formula rappresenta il rapporto degli atomi nel composto. Lo ione K+ ha una carica pari a +1 e lo ione Bri- ha una carica pari a -1, risultando in un composto neutro. La formula viene utilizzata per indicare la composizione del composto ed è essenziale per scrivere equazioni chimiche bilanciate.
Massa molare del bromuro di potassio
KBr ha una massa molare di 119,01 g/mol. È composto da un atomo di potassio e un atomo di bromo. La massa molare è una caratteristica importante di un composto perché viene utilizzata per determinare il numero di moli di una sostanza in un dato campione. Viene anche utilizzato in stechiometria per calcolare la massa di un prodotto o reagente in una reazione chimica.
Punto di ebollizione del bromuro di potassio
KBr ha un punto di ebollizione di 1.390 ° C (2.534 ° F). Questo alto punto di ebollizione è dovuto alla natura ionica del composto. Quando riscaldati, i legami ionici tra potassio e bromo richiedono una grande quantità di energia per rompersi, determinando un elevato punto di ebollizione. Il KBr è comunemente usato in laboratorio come fluido termovettore grazie al suo alto punto di ebollizione.
Bromuro di potassio Punto di fusione
KBr ha un punto di fusione di 734°C (1.353°F). Proprio come il punto di ebollizione, anche il punto di fusione è determinato dalla forza dei legami ionici tra gli atomi di potassio e bromo. Quando riscaldati, i legami ionici si indeboliscono e la struttura reticolare cristallina del composto si rompe, risultando in uno stato liquido.
Densità del bromuro di potassio g/mL
La densità di KBr è 2,75 g/mL a temperatura ambiente. La densità di una sostanza è definita come la massa di una sostanza per unità di volume. L’elevata densità di KBr è dovuta alla stretta struttura cristallina del composto. Questa proprietà lo rende utile nella realizzazione di materiali ottici come lenti e prismi.
Peso molecolare del bromuro di potassio
Il peso molecolare di KBr è 119,01 g/mol. Questo valore si calcola sommando le masse atomiche di potassio e bromo. Il peso molecolare viene utilizzato nei calcoli chimici come determinare la quantità di una sostanza necessaria per preparare una soluzione di una concentrazione specifica.
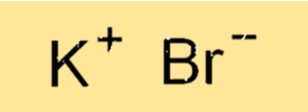
Struttura del bromuro di potassio
KBr ha una struttura cristallina costituita da un reticolo cubico a facce centrate. Ogni ione K+ è circondato da sei ioni Br- e ogni ione Bri- è circondato da sei ioni K+. Questa disposizione è caratteristica dei composti ionici, che hanno una disposizione regolare e ripetitiva degli ioni nella struttura cristallina.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 2,75 g/ml a 25°C |
| Colore | Incolore |
| Odore | Inodore |
| Massa molare | 119,01 g/mole |
| Densità | 2,75 g/cm³ |
| Punto di fusione | 734°C (1.353°F) |
| Punto di ebollizione | 1390°C (2534°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | 53 g/100 ml a 20°C |
| Solubilità | Solubile in alcool, acetone e ammoniaca |
| Pressione del vapore | 1 mmHg a 1114°C |
| Densità del vapore | Non applicabile |
| pKa | 7,5 (a 25°C) |
| pH | 7 (neutro) |
Sicurezza e pericoli del bromuro di potassio
KBr è generalmente considerato sicuro da usare, ma può comportare alcuni pericoli se maneggiato in modo improprio. È irritante per la pelle, gli occhi e le vie respiratorie e la sua ingestione può causare disturbi gastrointestinali. L’esposizione prolungata ad alte concentrazioni può causare problemi respiratori. Il KBr deve essere maneggiato con cura e durante la manipolazione del composto devono essere indossati dispositivi di protezione individuale adeguati, inclusi guanti e una maschera antipolvere. È inoltre importante conservare KBr in un’area fresca, asciutta e ben ventilata, lontano da materiali incompatibili. In caso di esposizione, consultare immediatamente un medico.
| Simboli di pericolo | Xi – Irritante |
| Descrizione della sicurezza | Evitare il contatto con la pelle e gli occhi. Indossare indumenti protettivi, guanti e occhiali/schermo facciale adeguati |
| protezione. | |
| Numeri di identificazione delle Nazioni Unite | ONU 1465 (Prodotti chimici, bromuro di potassio) |
| Codice SA | 28275100 |
| Classe di pericolo | 6.1 (Sostanze tossiche) |
| Gruppo di imballaggio | III |
| Tossicità | LD50 (orale, ratto) = 2.340 mg/kg |
Metodi per la sintesi del bromuro di potassio
Per sintetizzare KBr, si possono utilizzare vari metodi come la sintesi diretta, la doppia decomposizione e la titolazione acido-base.
KOH reagisce con il gas HBr per produrre KBr in sintesi diretta. La reazione produce KBr e acqua come sottoprodotti.
La doppia decomposizione prevede la reazione di un sale di potassio solubile con un sale di bromuro solubile, come cloruro di potassio e bromuro di sodio. La reazione produce KBr e cloruro di sodio .
La titolazione acido-base prevede la reazione di un sale bromuro con KOH . L’acido solforico diluito tratta prima il sale bromuro per formare Hbr, quindi il titolo KOH per produrre KBr e acqua.
Un altro metodo per sintetizzare KBr prevede la reazione del bromo con una soluzione calda di idrossido di potassio . Il solfito di sodio riduce il bromato di potassio, producendo KBr e bromato di potassio.
Usi del bromuro di potassio
KBr ha diversi usi in vari settori grazie alle sue proprietà uniche. Ecco alcuni degli usi comuni di KBr:
- Fotografia: ampiamente utilizzato nella fotografia in bianco e nero come fissatore fotografico per prevenire l’appannamento della carta fotografica.
- Medicina veterinaria: utilizzato come farmaco anticonvulsivante per cani e gatti affetti da convulsioni.
- Chimica analitica: utilizzato come standard di riferimento nella spettroscopia infrarossa in trasformata di Fourier (FTIR) per identificare i composti organici.
- Chimica farmaceutica: utilizzata nella preparazione di vari prodotti farmaceutici, inclusi sedativi, ipnotici e antiepilettici.
- Trivellazione petrolifera: utilizzato come fluido di completamento nella trivellazione petrolifera per prevenire l’afflusso di acqua di formazione e ridurre il rischio di corrosione.
- Ritardanti di fiamma: utilizzati come ritardanti di fiamma in plastica, tessuti e prodotti di carta.
- Sintesi chimica: utilizzato anche nelle reazioni di sintesi chimica, in particolare nella sintesi di vari composti organici e inorganici.
Domande:
D: In quali condizioni il bromuro di potassio può condurre l’elettricità?
R: Il KBr può condurre elettricità quando è allo stato fuso o quando è disciolto in acqua, consentendo ai suoi ioni di muoversi liberamente e trasportare una carica elettrica.
D: KBr è ionico o covalente?
R: KBr è un composto ionico formato dal trasferimento di elettroni dal potassio al bromo.
D: Il KBr è solubile in acqua?
R: Sì, KBr è altamente solubile in acqua, con una solubilità di 53,5 g/100 mL a 25°C.
D: Qual è la formula del bromuro di potassio?
R: La formula chimica del bromuro di potassio è KBr.
D: KBr è un acido o una base?
R: KBr è un sale e non ha proprietà acide o basiche.
D: Cos’è KBr?
R: KBr è il simbolo chimico del bromuro di potassio, un composto ionico utilizzato in vari settori per le sue proprietà uniche.
D: Quanta massa di KBr (in grammi) è necessaria per preparare 250,0 ml di una soluzione di KBr da 1,50 M?
R: Per preparare una soluzione di 1,50 M KBr in 250,0 ml di acqua, dovrai sciogliere 30,4 grammi di KBr in acqua.
