Il fluorometano (CH3F) è un gas incolore con un leggero odore etereo. Viene utilizzato nella produzione di elettronica, prodotti farmaceutici e come refrigerante. Non è molto tossico ma costituisce un potente gas serra.
| Nome IUPAC | Fluorometano |
| Formula molecolare | CH3F |
| numero CAS | 593-53-3 |
| Sinonimi | Fluoruro di metile, Freon 41, Halocarbon 41, R 41, UN 2452 |
| InChI | InChI=1S/CH3F/c1-2/h1H3 |
Proprietà del fluorometano
CH3F Punto di ebollizione
Il punto di ebollizione di CH3F è -78,4°C, che è relativamente basso. Ciò lo rende un refrigerante ideale per varie applicazioni come i sistemi di refrigerazione e condizionamento dell’aria. Il CH3F è utilizzato anche come propellente negli aerosol grazie al suo basso punto di ebollizione.
CH3F Massa molare
CH3F è un composto chimico con la formula molecolare CH3F. È noto anche come fluoruro di metile e ha una massa molare di 34,03 g/mol. CH3F è un gas incolore con un leggero odore etereo ed è ampiamente utilizzato in varie applicazioni grazie alle sue proprietà uniche.
CH3F Punto di fusione
CH3F ha un punto di fusione di -141°C, anch’esso relativamente basso. Il suo basso punto di fusione lo rende facile da maneggiare e trasportare, rendendolo una scelta popolare per varie applicazioni industriali. Il basso punto di fusione del CH3F lo rende adatto anche all’uso come refrigerante in applicazioni a bassa temperatura.
Densità CH3F
La densità di CH3F è 0,89 g/ml, che è relativamente bassa. Ciò la rende meno densa dell’aria, che ha una densità di 1,29 g/ml. Di conseguenza, il CH3F viene spesso utilizzato come gas più leggero dell’aria in varie applicazioni, tra cui il rilevamento di perdite, la gascromatografia e come gas di sollevamento per palloni e dirigibili.
Peso molecolare CH3F
Il peso molecolare di CH3F è 34,03 g/mol, che è relativamente basso. Ciò lo rende un composto leggero, facile da maneggiare e trasportare. Il CH3F è spesso utilizzato nella produzione di prodotti elettronici e farmaceutici grazie al suo basso peso molecolare e alle sue proprietà uniche.
Struttura di CH3F
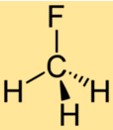
La struttura di CH3F è costituita da un singolo atomo di carbonio legato a tre atomi di idrogeno e un atomo di fluoro. L’atomo di fluoro è attaccato all’atomo di carbonio, sostituendo uno degli atomi di idrogeno nel metano. La struttura di CH3F lo rende un composto stabile con proprietà chimiche uniche.
Formula del fluorometano
La formula del fluorometano è CH3F, che rappresenta la disposizione degli atomi nella molecola. La formula mostra che il fluorometano è costituito da un atomo di carbonio, tre atomi di idrogeno e un atomo di fluoro. La formula viene utilizzata per descrivere la composizione chimica del fluorometano ed è importante in varie applicazioni.
| Aspetto | Gas incolore |
| Peso specifico | 0,89 a 20°C (aria = 1) |
| Colore | Incolore |
| Odore | Odore leggero ed etereo |
| Massa molare | 34,03 g/mole |
| Densità | 0,89 g/ml |
| Punto di fusione | -141°C |
| Punto di ebollizione | -78,4°C |
| Punto flash | Non infiammabile |
| solubilità in acqua | 0,5 g/l a 20°C |
| Solubilità | Miscibile in solventi organici |
| Pressione del vapore | 4,4 bar a 20°C |
| Densità del vapore | 1,43 (aria = 1) |
| pKa | 50.9 |
| pH | Non applicabile |
Sicurezza e pericoli del fluorometano
Il fluorometano è generalmente considerato un composto sicuro da maneggiare e utilizzare, a bassa tossicità e non infiammabile. Tuttavia, come qualsiasi sostanza chimica, presenta potenziali pericoli e considerazioni sulla sicurezza. L’esposizione ad alte concentrazioni di fluorometano può causare vertigini, mal di testa e nausea. È anche un potente gas serra che contribuisce al cambiamento climatico. Il fluorometano deve essere maneggiato in un’area ben ventilata e devono essere indossati dispositivi di protezione, come guanti e occhiali protettivi. È importante seguire le corrette procedure di stoccaggio e manipolazione per evitare perdite e rilasci accidentali nell’ambiente.
| Simboli di pericolo | F+ |
| Descrizione della sicurezza | Gas altamente infiammabile; Tossico per inalazione; Provoca irritazione cutanea; Provoca grave irritazione oculare; Può provocare sonnolenza o vertigini; Può causare danni agli organi |
| Identificatori AN | UN2452 |
| Codice SA | 2903.49.90 |
| Classe di pericolo | 2.1 |
| Gruppo di imballaggio | II |
| Tossicità | Bassa tossicità, ma può causare effetti sulla salute se inalato ad alte concentrazioni. |
Metodi di sintesi del fluorometano
Diversi metodi, tra cui la fluorurazione diretta del metano e le reazioni di scambio di alogeni, possono sintetizzare il fluorometano.
Un metodo comune è la reazione del metanolo con acido fluoridrico in presenza di un catalizzatore, come ossido di alluminio o fluoruro di alluminio.
Un altro metodo prevede la reazione del clorometano o del bromometano con il gas fluoruro di idrogeno. Entrambi questi metodi producono fluorometano come sottoprodotto, che può quindi essere separato e purificato mediante distillazione o altri metodi.
Un altro metodo per sintetizzare il fluorometano prevede la reazione di fluoroformio e acido cloridrico in presenza di un catalizzatore, come zinco o rame. Questa reazione produce una miscela di clorofluorometano e fluorometano, che può essere separata e purificata mediante distillazione.
Usi del fluorometano
Il fluorometano ha diversi usi in vari settori, tra cui:
- Refrigerazione: utilizzato come refrigerante nei sistemi di refrigerazione industriale e commerciale grazie al suo basso punto di ebollizione e alla sua non infiammabilità.
- Elettronica: utilizzato come detergente per componenti elettronici e come agente di incisione al plasma nell’industria dei semiconduttori.
- Applicazioni mediche: utilizzato come anestetico in medicina veterinaria grazie alla sua bassa tossicità e alla rapida azione.
- Produzione di pesticidi: utilizzato come precursore nella produzione di alcuni pesticidi, inclusi erbicidi e insetticidi.
- Produzione di polimeri: utilizzato come agente espandente nella produzione di schiume polimeriche, come la schiuma poliuretanica.
- Applicazioni di laboratorio: utilizzato come solvente e reagente in varie applicazioni di laboratorio, comprese la sintesi e l’analisi chimica.
- Soppressione degli incendi: utilizzato anche come agente estinguente in alcuni tipi di estintori, in particolare quelli utilizzati nelle sale computer e telecomunicazioni.
Domande:
D: CH3F è polare o non polare?
R: CH3F è una molecola polare a causa della disposizione asimmetrica degli atomi di fluoro e idrogeno attorno all’atomo di carbonio centrale, che dà luogo a un momento dipolare netto.
D: CH3F ha un legame idrogeno?
R: Il fluorometano non ha un legame idrogeno perché non contiene un atomo di idrogeno legato a un elemento altamente elettronegativo come azoto, ossigeno o fluoro.
D: Quale composto ha le forze intermolecolari più forti: HF, CH3Cl, CH3F, HCl?
R: L’HF ha le forze intermolecolari più forti grazie alla sua capacità di formare legami idrogeno, che sono più forti delle forze dipolo-dipolo di altri composti.
D: Quale ha le forze dipolo-dipolo più deboli: N2, CO, CH3F, HCl?
R: N2 ha le forze dipolo-dipolo più basse perché è una molecola non polare e quindi non ha un momento dipolare netto. CO, CH3F e HCl sono molecole polari e hanno forze dipolo-dipolo, ma l’intensità di queste forze aumenta nell’ordine HCl < CH3F < CO a causa della crescente polarità delle molecole.
