Il metanolo (CH3OH) è un liquido incolore e infiammabile con un odore dolce. Viene utilizzato come solvente, carburante e antigelo. Può essere tossico se ingerito e causare cecità o morte.
| Nome IUPAC | Metanolo |
| Formula molecolare | CH4O |
| numero CAS | 67-56-1 |
| Sinonimi | Alcol metilico, alcool metilico, idrossimetano, carbinolo, nafta di legno, spirito coloniale |
| InChI | InChI=1S/CH4O/c1-2/h2H,1H3 |
Nota: InChI è una lunga catena che rappresenta la struttura unica di una molecola. Potrebbe non essere visualizzato correttamente su alcuni dispositivi.
Proprietà del metanolo
Metanolo Massa molare
La massa molare del metanolo è 32,04 g/mol. Si calcola sommando i pesi atomici degli atomi di carbonio, idrogeno e ossigeno in una singola molecola di metanolo. Questo valore è utile per determinare la quantità di metanolo necessaria per preparare una certa concentrazione di una soluzione o per determinare la stechiometria di una reazione chimica.
Punto di ebollizione del metanolo
Il metanolo ha un punto di ebollizione di 64,7°C (148,46°F). Questo punto di ebollizione relativamente basso rende il metanolo utile come solvente in varie applicazioni industriali, inclusa la produzione di formaldeide, acido acetico e metil metacrilato. Tuttavia, il basso punto di ebollizione del metanolo lo rende anche volatile e infiammabile, il che può comportare rischi per la sicurezza durante lo stoccaggio, la movimentazione e il trasporto.
Punto di fusione del metanolo
CH3OH ha un punto di fusione di -97,6°C (-143,68°F). Ciò significa che CH3OH è un liquido a temperatura ambiente ma può essere facilmente congelato in forma solida raffreddandolo al di sotto del punto di fusione. Il basso punto di fusione di CH3OH è utile anche in alcune applicazioni di laboratorio, come la preparazione di solventi criogenici per la spettroscopia di risonanza magnetica nucleare.
Densità del metanolo g/mL
La densità di CH3OH è 0,792 g/mL a 20°C (68°F). Ciò significa che CH3OH è meno denso dell’acqua e può galleggiare su di essa. La densità di CH3OH può essere utilizzata anche per calcolare il volume di CH3OH necessario per ottenere una determinata massa o concentrazione della soluzione.
Peso molecolare del metanolo
Il peso molecolare di CH3OH è 32,04 g/mol. Questo valore viene calcolato sommando i pesi atomici degli atomi di carbonio, idrogeno e ossigeno in una singola molecola CH3OH. Il peso molecolare di CH3OH è utile per determinarne le proprietà fisiche, come il punto di ebollizione, il punto di fusione e la densità.
Struttura del metanolo
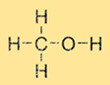
Il metanolo ha una struttura semplice costituita da un gruppo metilico (CH3) e un gruppo ossidrile (-OH) attaccati a un singolo atomo di carbonio. La formula molecolare del metanolo è CH3OH. Il metanolo è una molecola polare a causa della presenza del gruppo ossidrile, che lo rende solubile in solventi polari come acqua ed etanolo.
Formula del metanolo
La formula chimica del metanolo è CH3OH. Ciò significa che ciascuna molecola di metanolo contiene un atomo di carbonio, quattro atomi di idrogeno e un atomo di ossigeno. La formula del metanolo può essere utilizzata per determinare il peso molecolare e altre proprietà fisiche del metanolo. La formula chimica del metanolo è utile anche per scrivere equazioni chimiche e bilanciare le reazioni chimiche che coinvolgono il metanolo.
| Aspetto | Liquido incolore |
| Peso specifico | 0,792 g/ml a 20°C |
| Colore | Incolore |
| Odore | Dolce, piccante |
| Massa molare | 32,04 g/mole |
| Densità | 0,792 g/ml a 20°C |
| Punto di fusione | -97,6°C |
| Punto di ebollizione | 64,7°C |
| Punto flash | 11,1°C |
| solubilità in acqua | Miscibile |
| Solubilità | Miscibile con etanolo, etere, acetone e molti solventi organici |
| Pressione del vapore | 13,02 kPa a 20°C |
| Densità del vapore | 1.11 (aria = 1) |
| pKa | 15.5 |
| pH | 7 (neutro) |
Nota: i valori elencati in questa tabella sono approssimativi e possono variare a seconda delle condizioni specifiche e delle fonti di metanolo.
Sicurezza e pericoli del metanolo
CH3OH comporta vari rischi per la sicurezza e deve essere maneggiato con cautela. È un liquido infiammabile e può accendersi se esposto a calore, scintille o fiamme. I vapori di CH3OH possono anche formare miscele esplosive con l’aria. L’inalazione dei vapori CH3OH può causare vertigini, mal di testa, nausea e altri problemi di salute. Anche il CH3OH è tossico e può essere assorbito attraverso la pelle o ingerito, provocando gravi complicazioni alla salute tra cui cecità, coma e morte. È importante indossare indumenti protettivi e maneggiare CH3OH in un’area ben ventilata con attrezzature di sicurezza adeguate, come occhiali, guanti e un respiratore. Le fuoriuscite devono essere ripulite immediatamente e smaltite adeguatamente.
| Simboli di pericolo | Teschio e ossa incrociate, infiammabile |
| Descrizione della sicurezza | Tenere lontano da fonti di calore/scintille/fiamme libere/superfici calde. Utilizzare apparecchiature elettriche/di ventilazione/illuminazione a prova di esplosione. Tieni il contenitore chiuso ermeticamente. Container messo a terra/svuotato e attrezzatura di ricezione. Utilizzare solo strumenti antiscintilla. Adottare misure precauzionali contro le scariche elettrostatiche. Evitare di respirare i vapori. Lavare bene dopo aver maneggiato. Non mangiare, bere o fumare durante l’utilizzo di questo prodotto. |
| Identificatori AN | ONU1230 |
| Codice SA | 29051100 |
| Classe di pericolo | 3 |
| Gruppo di imballaggio | II |
| Tossicità | Il metanolo è tossico e può causare cecità, coma e morte se ingerito, inalato o assorbito attraverso la pelle. Può anche causare irritazioni, arrossamenti e ustioni al contatto. L’esposizione ai vapori di metanolo può causare mal di testa, vertigini, nausea e altri problemi di salute. Il metanolo deve essere maneggiato con estrema cautela e con adeguati dispositivi di protezione. |
Nota: i valori elencati in questa tabella sono approssimativi e possono variare a seconda delle condizioni specifiche e delle fonti di metanolo. È importante fare riferimento alla scheda di sicurezza e alle normative vigenti quando si maneggia il metanolo.
Metodi di sintesi del metanolo
L’ossidazione diretta del metano, l’ossidazione parziale del gas naturale, la gassificazione del carbone e la sintesi da anidride carbonica e idrogeno sintetizzano tutte il metanolo.
Uno dei metodi più comuni per sintetizzare il metanolo è convertire cataliticamente il gas di sintesi, che è una miscela di monossido di carbonio, anidride carbonica e idrogeno. Questo processo prevede l’uso di un catalizzatore, solitamente a base di rame, per facilitare la reazione. Il gas di sintesi viene introdotto in un reattore contenente il catalizzatore a temperature e pressioni elevate, con conseguente produzione di metanolo.
Un altro metodo per sintetizzare il metanolo prevede l’ossidazione diretta del metano, che prevede l’uso di temperature e pressioni elevate in presenza di un catalizzatore come platino o palladio. Questo metodo è più difficile e più costoso del metodo del syngas, ma è più efficiente e può produrre rendimenti più elevati.
L’ossidazione parziale del gas naturale è un altro metodo di sintesi del metanolo, che prevede l’uso di ossigeno o aria per ossidare parzialmente il gas naturale, producendo una miscela di monossido di carbonio e idrogeno. La miscela viene quindi introdotta in un reattore contenente un catalizzatore, con conseguente produzione di metanolo.
La gassificazione del carbone è un altro metodo di sintesi del metanolo, che prevede la conversione del carbone in gas di sintesi, seguita dallo stesso processo di conversione catalitica descritto sopra.
La cattura e l’utilizzo del carbonio converte le emissioni di anidride carbonica provenienti dai processi industriali in metanolo, utilizzando l’idrogeno come agente riducente.
Usi del metanolo
Il metanolo ha una vasta gamma di usi in vari settori, tra cui:
- Carburante: veicoli, generatori e altre apparecchiature industriali possono utilizzare il metanolo come carburante.
- Solvente: il metanolo è un ottimo solvente per molte sostanze, tra cui resine, coloranti e oli. I produttori utilizzano il metanolo per produrre pitture, vernici e altri rivestimenti.
- Intermedio chimico: utilizzato come materia prima per la produzione di formaldeide, acido acetico e altri prodotti chimici.
- Antigelo: utilizzato come agente antigelo nei sistemi di raffreddamento delle automobili.
- Agente antighiaccio: utilizzato come agente antighiaccio per le ali degli aerei e le piste degli aeroporti.
- Detergente: utilizzato come detergente in vari processi industriali.
- Prodotti farmaceutici: utilizzato come solvente nella produzione di molti prodotti farmaceutici.
- Energia alternativa: studiata come combustibile alternativo per celle a combustibile e come potenziale mezzo di stoccaggio dell’energia.
- Metanolo in olefine (MTO): le olefine come l’etilene e il propilene provengono dalla conversione del metanolo.
- Metanolo in benzina (MTG): un processo chiamato MTG converte il metanolo in benzina.
Domande:
D: Cos’è il metanolo?
R: Il metanolo, noto anche come alcol metilico, è un liquido incolore e infiammabile con un odore dolce. È l’alcol più semplice e la sua formula chimica è CH3OH.
D: Il metanolo è polare o non polare?
R: Il metanolo è una molecola polare. Ha una carica parziale positiva sugli atomi di idrogeno e una carica parziale negativa sull’atomo di ossigeno, risultando in un momento di dipolo.
D: A cosa serve il metanolo?
R: Il metanolo ha un’ampia gamma di usi in vari settori, tra cui come combustibile, solvente, intermedio chimico, antigelo, agente antighiaccio, detergente, solvente farmaceutico e potenziale mezzo di stoccaggio dell’energia. Viene anche utilizzato nella produzione di formaldeide, acido acetico e altri prodotti chimici. Inoltre, il metanolo viene convertito in olefine come etilene e propilene, che vengono utilizzate come materie prime per la produzione di plastica.
