Il perossido di sodio (Na2O2) è un potente agente ossidante. Reagisce violentemente con l’acqua liberando ossigeno e può accendere materiali combustibili al contatto. Viene utilizzato in varie reazioni chimiche e come disinfettante.
| Nome IUPAC | ossido di sodio |
| Formula molecolare | Na2O2 |
| numero CAS | 1313-60-6 |
| Sinonimi | Perossido di sodio, superossido di sodio, biossido di disodio, binossido di sodio, biossido di sodio, NaO2, UN 1507 |
| InChI | InChI=1S/2Na.O2/c;;1-2/q2*+1;-2 |
Proprietà del perossido di sodio
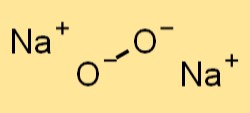
Formula di perossido di sodio
La formula chimica del perossido di sodio è Na2O2. È un composto ionico composto da due cationi sodio (Na+) e un anione perossido (O22-). La formula del perossido di sodio viene utilizzata per rappresentare la composizione chimica del composto ed è importante nelle reazioni chimiche che coinvolgono la sostanza.
Massa molare del perossido di sodio
Il perossido di sodio, formula chimica Na2O2, ha una massa molare di 77,98 g/mol. È un composto ionico composto da due cationi sodio (Na+) e un anione perossido (O22-). La massa molare del perossido di sodio è essenziale per calcolare la quantità di composto necessaria per varie reazioni chimiche.
Punto di ebollizione del perossido di sodio
Il perossido di sodio ha un punto di ebollizione molto elevato di 657°C (1215°F), che lo rende estremamente stabile alle alte temperature. Il composto si decompone prima di raggiungere il punto di ebollizione, rilasciando gas ossigeno e lasciando dietro di sé ossido di sodio. L’alto punto di ebollizione del perossido di sodio lo rende utile nelle reazioni ad alta temperatura e nei processi industriali dove è richiesta un’elevata stabilità termica.
Punto di fusione del perossido di sodio
Il perossido di sodio ha un punto di fusione di 675°C (1247°F), che è relativamente alto rispetto ad altre sostanze comuni. Si scioglie per formare un liquido bianco-giallastro e si decompone al di sopra del punto di fusione per rilasciare gas ossigeno e formare ossido di sodio. L’alto punto di fusione del perossido di sodio lo rende utile nelle reazioni chimiche ad alte temperature.
Densità del perossido di sodio g/ml
La densità del perossido di sodio è 2,805 g/mL. È una polvere da bianca a giallastra con una densità maggiore di quella dell’acqua. L’elevata densità del perossido di sodio lo rende utile in vari processi industriali come lo sbiancamento, la disinfezione e la produzione di altri prodotti chimici.
Peso molecolare del perossido di sodio
Il perossido di sodio ha un peso molecolare di 77,98 g/mol. È un composto ionico con due cationi sodio (Na+) e un anione perossido (O22-). Il peso molecolare del perossido di sodio è importante nelle reazioni chimiche che coinvolgono il composto perché aiuta a determinare la quantità di reagenti e prodotti.
Struttura del perossido di sodio
Il perossido di sodio ha una struttura cristallina simile al cloruro di sodio (NaCl). Forma un reticolo cubico a facce centrate, dove gli ioni sodio occupano gli angoli del cubo e gli anioni perossido si trovano al centro di ciascuna faccia. Gli anioni perossido nel perossido di sodio sono tenuti insieme da legami covalenti, mentre gli ioni sodio sono tenuti insieme da legami ionici.
| Aspetto: | Polvere da bianca a giallastra |
| Peso specifico: | 2.805 g/cm3 |
| Colore: | Da bianco a giallastro |
| Odore: | Inodore |
| Massa molare: | 77,98 g/mole |
| Densità: | 2.805 g/cm3 |
| Punto di fusione: | 675°C (1247°F) |
| Punto di ebollizione: | 657°C (1215°F) |
| Punto d’infiammabilità: | Non applicabile |
| Solubilità in acqua: | Reagisce violentemente con l’acqua |
| Solubilità: | Solubile in alcool, etere |
| Pressione del vapore: | Non applicabile |
| Densità del vapore: | Non applicabile |
| pKa: | Non applicabile |
| PH: | Non applicabile |
Sicurezza e pericoli del perossido di sodio
| Simboli di pericolo: | Ossidante, Corrosivo |
| Descrizione della sicurezza: | Non respirare polvere/fumi/gas/nebbia/vapori. Evitare il contatto con la pelle/gli occhi. Manipolare e conservare sotto gas inerte. In caso di contatto con gli occhi, immediatamente con abbondante acqua e risciacquare un medico. In caso di incendio utilizzare mezzi estinguenti adeguati. |
| Numeri di identificazione ONU: | UN1503 |
| Codice SA: | 2829.11.00 |
| Classe di pericolo: | 5.1 |
| Gruppo di imballaggio: | II |
| Tossicità: | Corrosivo per gli occhi e la pelle, nocivo se ingerito o inalato. |
Metodi per la sintesi del perossido di sodio
La sintesi del perossido di sodio (Na2O2) è possibile attraverso diversi metodi, come la combinazione diretta, la reazione con l’ossigeno e l’elettrolisi.
Un metodo per sintetizzare Na2O2 è il metodo di combinazione diretta. Ciò comporta il riscaldamento del sodio metallico con l’ossigeno in eccesso in una fornace. La reazione è esotermica ed è fondamentale regolare la temperatura per evitare surriscaldamenti e possibili esplosioni.
Un altro metodo prevede la reazione dell’idrossido di sodio con il perossido di idrogeno per produrre Na2O2 e acqua. Questo metodo è più sicuro e più controllato rispetto al metodo di combinazione diretta ma richiede una temperatura più elevata e un tempo di reazione più lungo.
Un altro metodo per sintetizzare Na2O2 è attraverso l’elettrolisi. Ciò comporta l’elettrolisi di una soluzione di idrossido di sodio utilizzando un anodo e un catodo adatti. Durante l’elettrolisi, il catodo produce Na2O2, mentre l’anodo produce ossigeno gassoso.
Usi del perossido di sodio
Il perossido di sodio trova varie applicazioni industriali e di laboratorio grazie alle sue proprietà ossidanti e alla capacità di rilasciare ossigeno.
Ecco alcuni usi comuni del perossido di sodio:
- Candeggina: utilizzata come agente sbiancante per pasta di carta, tessuti e altri materiali.
- Agente deodorante: utilizzato come agente deodorante negli impianti di smaltimento dei rifiuti e di trattamento delle acque reflue.
- Agente ossidante: utilizzato per ossidare vari composti organici e inorganici.
- Polimerizzazione: avvia la polimerizzazione di alcuni monomeri. Utilizzato nella produzione di schiuma poliuretanica e altri polimeri.
- Applicazioni farmaceutiche: utilizzato come reagente nella sintesi di composti farmaceutici.
- Reagente di laboratorio: utilizzato come reagente di laboratorio per vari scopi analitici e sintetici.
- Applicazioni delle celle a combustibile: utilizzato come ossidante nelle celle a combustibile per generare energia elettrica.
Domande:
D: Qual è la reazione chimica tra il perossido di idrogeno e il bisolfito di sodio?
R: La reazione chimica tra perossido di idrogeno e bisolfito di sodio produce acqua e solfato di sodio. L’equazione bilanciata per la reazione è: 2 NaHSO3 + H2O2 → Na2SO4 + 2 H2O.
D: Dove acquistare la polvere di perossido di sodio?
R: La polvere di perossido di sodio può essere acquistata da vari fornitori e distributori di prodotti chimici. È importante garantire che il fornitore sia affidabile e segua protocolli di sicurezza adeguati per la manipolazione e la spedizione di sostanze chimiche pericolose.
D: L’ossido di sodio può essere trasformato in boroidruro e perossido di idrogeno?
R: L’ossido di sodio non può essere prodotto direttamente dal boroidruro e dal perossido di idrogeno. L’ossido di sodio può essere sintetizzato mediante la reazione del sodio metallico con l’ossigeno o riscaldando l’idrossido di sodio. Il boroidruro e il perossido di idrogeno non sono comunemente usati nella sintesi dell’ossido di sodio.
D: Qual è la formula del perossido di sodio?
R: La formula del perossido di sodio è Na2O2.
D: Qual è lo stato di ossidazione di Na2O2?
R: Lo stato di ossidazione del sodio in Na2O2 è +1 e lo stato di ossidazione dell’ossigeno è -1.
D: Qual è il numero di ossidazione dell’ossigeno nel composto Na2O2?
R: Il numero di ossidazione dell’ossigeno nel composto Na2O2 è -1.
