Il cloruro di calcio è un composto inorganico altamente solubile con la formula CaCl2. È comunemente usato come agente antighiaccio, essiccante e nella produzione di sali di calcio e prodotti chimici.
| Nome IUPAC | Cloruro di calcio |
| Formula molecolare | CaCl2 |
| numero CAS | 10043-52-4 |
| Sinonimi | Cloruro di calcio, cloruro di calcio (II). |
| E509, sale decapante, Dowflake, Peladow, TETRA | |
| InChI | InChI=1S/Ca.2ClH/h;2*1H/q+2;;/p-2 |
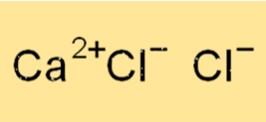
Formula del cloruro di calcio
La formula chimica del cloruro di calcio è CaCl2. Ciò significa che ciascuna unità di cloruro di calcio è composta da uno ione calcio (Ca2+) e due ioni cloruro (Cl-). Il cloruro di calcio è un composto ionico, il che significa che è tenuto insieme dall’attrazione elettrostatica tra lo ione calcio caricato positivamente e gli ioni cloruro caricati negativamente.
Massa molare del cloruro di calcio
Il cloruro di calcio ha una massa molare di 110,98 g/mol, che corrisponde alla somma delle masse atomiche di un atomo di Ca e di due atomi di Cl. È un composto inorganico altamente solubile in acqua. acqua e comunemente usato come agente essiccante, essiccante e agente antighiaccio. Il cloruro di calcio viene utilizzato anche nella produzione di sali di calcio e altri prodotti chimici.
Punto di ebollizione di CaCl2
Il punto di ebollizione di CaCl2 è 1935°C, che è molto alto per un composto inorganico. Ciò è dovuto ai forti legami ionici tra gli ioni Ca+2 e Cl-, che richiedono molta energia per rompersi. CaCl2 è un composto igroscopico, il che significa che assorbe l’umidità dall’aria e può dissolversi in acqua per formare una soluzione altamente concentrata.
Punto di fusione di CaCl2
CaCl2 ha un punto di fusione di 772°C. Ha una struttura cristallina e solitamente si trova nella sua forma anidra, ovvero non contiene molecole d’acqua. Quando CaCl2 viene riscaldato, si decompone in ossido di calcio e gas di acido cloridrico.
Densità di CaCl2 g/ml
La densità di CaCl2 dipende dalla concentrazione della soluzione. Una soluzione 1 M di CaCl2 ha una densità di circa 1,4 g/mL, mentre una soluzione 3 M ha una densità di circa 1,6 g/mL. La densità del CaCl2 solido è 2,15 g/cm³.
Peso molecolare di CaCl2
Il peso molecolare di CaCl2 è 110,98 g/mol. È un composto inorganico composto da un atomo di Ca e due atomi di Cl. CaCl2 è un solido cristallino bianco a temperatura ambiente ed è altamente solubile in acqua.
Struttura di CaCl2
CaCl2 ha una struttura reticolare cristallina, tenuta insieme da legami ionici tra il catione calcio (Ca2+) e l’anione cloruro (Cl-). Ogni ione Ca+2 è circondato da sei ioni Cl- e ogni ione cloruro è circondato da sei ioni calcio. La struttura cristallina di CaCl2 è cubica, con ciascuna cella unitaria contenente uno ione calcio e due ioni cloruro.
| Aspetto | Solido bianco |
| Peso specifico | 2,15 (solido), 1,4-1,6 (soluzione) |
| Colore | Incolore |
| Odore | Inodore |
| Massa molare | 110,98 g/mole |
| Densità | 2,15 g/cm³ (solido), 1,4-1,6 g/cm³ (soluzione) |
| Punto di fusione | 772°C |
| Punto di ebollizione | 1935°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Molto solubile in acqua |
| Solubilità | Solubile in etanolo e acetone |
| Pressione del vapore | Trascurabile |
| Densità del vapore | Non applicabile |
| pKa | – |
| pH | 4,5-11,0 (soluzione al 10%) |
Sicurezza e pericoli del cloruro di calcio
CaCl2 può causare irritazione alla pelle e agli occhi e l’inalazione della sua polvere o nebbia può causare irritazione alle vie respiratorie. Può anche causare ustioni se entra in contatto con la pelle o gli occhi. CaCl2 è igroscopico, il che significa che può assorbire umidità e rilasciare calore, che può causare la rottura o l’esplosione dei contenitori. È anche corrosivo per alcuni metalli e può reagire con alcuni materiali organici. Quando si maneggia CaCl2 è necessario utilizzare dispositivi di protezione adeguati, come guanti e occhiali protettivi. Le fuoriuscite devono essere pulite immediatamente e i contenitori conservati in un’area fresca, asciutta e ben ventilata.
| Simboli di pericolo | Corrosivo, irritante |
| Descrizione della sicurezza | Indossare guanti protettivi e proteggere gli occhi/il viso. Non respirare polvere/fumi/gas/nebbia/vapori. |
| Numeri di identificazione delle Nazioni Unite | ONU 3077, ONU 1786 (oncia idrata) |
| Codice SA | 2827.39.90 |
| Classe di pericolo | 8 (Sostanze corrosive) |
| Gruppo di imballaggio | III |
| Tossicità | La tossicità è bassa per la maggior parte delle applicazioni, ma può essere pericolosa in grandi quantità |
Metodi per la sintesi del cloruro di calcio
Per sintetizzare CaCl2 sono disponibili diversi metodi.
Un metodo prevede la reazione del carbonato di calcio o dell’idrossido di calcio con acido cloridrico . Un metodo consiste nell’aggiungere carbonato di calcio o idrossido di calcio all’acido cloridrico . La soluzione evapora per dare CaCl2.
Un altro metodo consiste nel far reagire l’ossido di calcio con l’acido cloridrico . Questo metodo prevede l’aggiunta di ossido di calcio all’acido cloridrico e quindi l’evaporazione della soluzione per ottenere CaCl2.
Un terzo metodo prevede la reazione del calcio metallico con il cloro gassoso. Un metodo meno comune consiste nel riscaldare il calcio metallico in presenza di gas di cloro. La reazione produce CaCl2, ma gli esperti non utilizzano spesso questo approccio a causa dell’elevata reattività del calcio metallico e della necessità di una manipolazione specializzata.
Per produrre CaCl2 utilizzando un metodo diverso, è possibile utilizzare il sottoprodotto del processo Solvay, che genera cloruro di sodio e CaCl2. Il processo prevede l’estrazione di CaCl2 dal sottoprodotto attraverso tecniche di filtrazione, evaporazione e purificazione. Questi passaggi aiutano a rimuovere tutte le impurità e a produrre CaCl2 ad elevata purezza.
Usi del cloruro di calcio
CaCl2 ha molte applicazioni industriali:
- Utilizzato come essiccante per assorbire l’umidità, agente antigelo per strade e marciapiedi e coagulante nella produzione di tofu e altri alimenti.
- Utilizzato nell’industria petrolifera e del gas per aumentare la densità dei fluidi di perforazione e ridurre il punto di congelamento dell’acqua nelle condutture.
- Utilizzato negli impasti di calcestruzzo per accelerare il processo di stagionatura e aumentare la resistenza e la durabilità del prodotto finito.
- Utilizzato nella produzione di carta per aumentare la resistenza e la stabilità delle fibre di carta.
- Utilizzato nel trattamento dell’acqua per rimuovere le impurità e addolcire l’acqua.
- Utilizzato come fonte di ioni calcio in applicazioni mediche, come fluidi endovenosi e per trattare l’ipocalcemia.
- Utilizzato nella produzione di plastica e gomma per aumentare la durezza e la durata del prodotto finale.
- Utilizzato nella conservazione di frutta e verdura per prevenirne il deterioramento e per mantenere la consistenza e il sapore del prodotto.
- Utilizzato nella produzione tessile per migliorare l’assorbimento del colorante e aumentare la resistenza e la flessibilità delle fibre.
- Utilizzato anche nella produzione di estintori e come componente di materiali ritardanti di fiamma per prevenire la propagazione delle fiamme.
Domande:
D: Cos’è il cloruro di calcio?
R: Il cloruro di calcio è un composto chimico composto da ioni Ca2+ e Cl- con la formula chimica CaCl2.
D: Il cloruro di calcio è ionico o covalente?
R: CaCl2 è un composto ionico perché è composto da ioni Ca2+ con carica positiva e ioni Cl- con carica negativa, tenuti insieme da legami ionici.
D: A cosa serve il cloruro di calcio?
R: CaCl2 ha molti usi industriali, commerciali e medici, tra cui come essiccante, agente antighiaccio, coagulante nella produzione alimentare, acceleratore nel calcestruzzo, addolcitore d’acqua e fonte di ioni calcio nei trattamenti medici.
D: Qual è la formula del cloruro di calcio?
R: La formula del cloruro di calcio è CaCl2, che indica che ciascuna molecola contiene uno ione calcio e due ioni cloruro.
D: CaCl2 è ionico o covalente?
R: CaCl2 è un composto ionico perché è composto da ioni calcio caricati positivamente e ioni cloruro caricati negativamente, tenuti insieme da legami ionici.
D: CaCl2 è solubile in acqua?
R: Sì, CaCl2 è altamente solubile in acqua, il che significa che può facilmente dissolversi in acqua per formare una soluzione limpida.
D: Se CaCl2 è disciolto in acqua, cosa possiamo dire sulla concentrazione dello ione Ca2+?
R: Quando CaCl2 viene sciolto in acqua, si dissocia nei suoi ioni costituenti, Ca2+ e 2Cl-. Poiché CaCl2 si dissocia completamente in acqua, la concentrazione di ioni Ca2+ in soluzione è doppia rispetto alla concentrazione di CaCl2.
