Il nitrato di magnesio è un composto cristallino bianco con la formula chimica Mg(NO3)2. Viene utilizzato nella produzione di fertilizzanti, esplosivi e prodotti pirotecnici grazie alla sua elevata reattività e proprietà ossidanti.
| Nome IUPAC | Dinitrato di magnesio |
| Formula molecolare | Mg(NO3)2 |
| numero CAS | 10377-60-3 |
| Sinonimi | Acido nitrico, sale di magnesio; ONU 1474; Nitrato di magnesio (II); Sale di magnesio dell’acido nitrico (2+) |
| InChI | InChI=1S/Mg.2NO3/c;22-1(3)4/q+2;2-1 |
Formula di nitrato di magnesio
La formula chimica del nitrato di magnesio è Mg(NO3)2, che indica che il composto contiene un catione di magnesio (Mg²⁺) e due anioni nitrato (NO₃⁻). Questa formula viene utilizzata per rappresentare la stechiometria del composto nelle equazioni chimiche e viene anche utilizzata per determinare il peso molecolare e altre proprietà del nitrato di magnesio.
Massa molare del nitrato di magnesio
La massa molare del nitrato di magnesio, rappresentata dalla formula chimica Mg(NO3)2, è di circa 148,31 g/mol. Questo valore può essere calcolato sommando le masse atomiche di magnesio (24,31 g/mol ciascuno), due atomi di azoto (28,02 g/mol ciascuno) e sei atomi di ossigeno (16,00 g/mol ciascuno) presenti nel composto. Conoscere la massa molare è fondamentale per determinare la quantità di nitrato di magnesio necessaria per le reazioni chimiche o per la preparazione di soluzioni.
Punto di ebollizione del nitrato di magnesio
Mg(NO3)2 ha un punto di ebollizione relativamente alto di circa 330°C (626°F) a pressione atmosferica. Questo valore può variare leggermente a seconda della purezza e della concentrazione del composto. Il punto di ebollizione di Mg(NO3)2 è importante nei processi industriali che coinvolgono la produzione di fertilizzanti, esplosivi e articoli pirotecnici, nonché negli esperimenti di laboratorio.
Punto di fusione del nitrato di magnesio
Il punto di fusione di Mg(NO3)2, che è la temperatura alla quale il composto solido passa allo stato liquido, è di circa 89°C (192°F) per la forma anidra e 95°C (203°F) per la forma anidra. forma anidra. forma esaidrata. La forma esaidrata di Mg(NO3)2 è più comunemente utilizzata grazie alla sua stabilità e facilità di manipolazione. Il punto di fusione è una proprietà fisica essenziale utilizzata per determinare la purezza del Mg(NO3)2 nonché in vari processi industriali.
Densità del nitrato di magnesio g/ml
La densità di Mg(NO3)2 varia a seconda della forma del composto. La forma anidra ha una densità di circa 2,3 g/cm³, mentre la forma esaidrata ha una densità di circa 1,46 g/cm³. La densità di Mg(NO3)2 è un fattore cruciale nel determinare il volume del composto richiesto nelle reazioni chimiche, nonché per la sua conservazione e trasporto.
Peso molecolare del nitrato di magnesio
Il peso molecolare di Mg(NO3)2, che è la somma dei pesi atomici di tutti gli elementi del composto, è di circa 148,31 g/mol. Questo valore è importante in vari calcoli chimici, in particolare per determinare la quantità di Mg(NO3)2 richiesta nelle reazioni o nella preparazione di soluzioni.
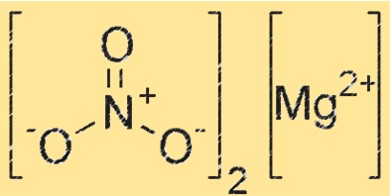
Struttura del nitrato di magnesio
Mg(NO3)2 ha una struttura cristallina che appartiene al sistema cristallino ortorombico. Il composto è costituito da cationi magnesio (Mg²⁺) e anioni nitrato (NO₃⁻), con ciascun catione magnesio circondato da sei anioni nitrato in una disposizione ottaedrica. La struttura cristallina di Mg(NO3)2 gioca un ruolo cruciale nella sua reattività e proprietà.
| Aspetto | Solido cristallino bianco |
| Peso specifico | 2,3 (anidro), 1,46 (esaidrato) |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 148,31 g/mole |
| Densità | 2,3 g/cm³ (anidro), 1,46 g/cm³ (esaidrato) |
| Punto di fusione | 89°C (anidro), 95°C (esaidrato) |
| Punto di ebollizione | 330°C |
| Punto flash | Non applicabile |
| solubilità in acqua | 234 g/L (anidro), 156 g/L (esaidrato) a 20°C |
| Solubilità | Solubile in acqua, etanolo, metanolo |
| Pressione del vapore | 0,000009 mmHg a 20°C |
| Densità del vapore | Non applicabile |
| pKa | 1.8 |
| pH | 4,5-6,0 (soluzione al 5%) |
Sicurezza e pericoli del nitrato di magnesio
Il Mg(NO3)2 può comportare vari rischi per la sicurezza se non maneggiato correttamente. Può causare irritazioni e ustioni alla pelle, agli occhi e alle vie respiratorie per contatto o inalazione. Il composto è anche un forte agente ossidante e può reagire violentemente con materiali organici, comprese sostanze infiammabili e combustibili. L’inalazione di polvere di Mg(NO3)2 può causare irritazione respiratoria e persino danni ai polmoni. Conservare e maneggiare Mg(NO3)2 in un’area fresca, asciutta e ben ventilata, lontano da fonti di ignizione. Quando si maneggia questo composto, utilizzare dispositivi di protezione individuale adeguati come guanti e occhiali di sicurezza.
| Simboli di pericolo | Agente ossidante |
| Descrizione della sicurezza | Evitare il contatto con materiali combustibili. Indossare dispositivi di protezione individuale. Tenere lontano da fonti di ignizione. |
| Identificatori AN | ONU 1474 |
| Codice SA | 283429 |
| Classe di pericolo | 5.1 (Agenti ossidanti) |
| Gruppo di imballaggio | II |
| Tossicità | LD50 (orale, ratto): 3.500 mg/kg; LD50 (cutaneo, coniglio): > 2000 mg/kg. Il nitrato di magnesio non è considerato cancerogeno, mutageno o teratogeno. |
Metodi di sintesi del nitrato di magnesio
Il nitrato di magnesio (Mg(NO3)2) può essere sintetizzato con diversi metodi, inclusa la reazione dell’ossido di magnesio o dell’idrossido di magnesio con l’acido nitrico.
Un metodo prevede l’aggiunta di ossido di magnesio a una soluzione di acido nitrico in un pallone, quindi il riscaldamento delicato della miscela finché non si scioglie. Per ottenere i cristalli di Mg(NO3)2, filtrare la soluzione per eliminare le impurità ed evaporare il solvente.
Un altro metodo di sintesi prevede la reazione del magnesio metallico con l’acido nitrico . Aggiungere le strisce di magnesio all’acido e lasciare che la reazione continui finché tutto il metallo non si dissolve. Quindi evaporare la soluzione ottenuta per ottenere i cristalli di Mg(NO3)2.
Sciogliere il carbonato di magnesio nell’acido nitrico per formare Mg(NO3)2 e anidride carbonica. Filtrare la soluzione risultante ed evaporarla per ottenere cristalli di Mg(NO3)2.
Un altro metodo consiste nel far reagire l’idrossido di magnesio con l’acido nitrico per produrre Mg(NO3)2 e acqua. La soluzione ottenuta viene quindi purificata mediante filtrazione ed evaporazione per ottenere cristalli di Mg(NO3)2.
Usi del nitrato di magnesio
Il nitrato di magnesio ha molti usi in vari settori e applicazioni. Alcuni degli usi principali di Mg(NO3)2 sono:
- Agricoltura: utilizzato come fertilizzante, soprattutto per le colture che richiedono alti livelli di magnesio, come pomodori, peperoni e agrumi. Aiuta a migliorare la crescita delle piante e migliora la qualità e la resa del raccolto.
- Prodotti pirotecnici: utilizzati come ossidante nei fuochi d’artificio e in altre applicazioni pirotecniche perché possono produrre fiamme luminose e intense e aiutare a controllare la velocità di combustione.
- Produzione del vetro: utilizzato come fondente nella produzione del vetro per abbassare il punto di fusione del vetro e migliorarne le proprietà di flusso.
- Sintesi chimica: utilizzato come reagente in varie reazioni di sintesi chimica, come la produzione di altri composti di magnesio, catalizzatori e prodotti farmaceutici.
- Conservazione: utilizzato come conservante alimentare per inibire la crescita di batteri e altri microrganismi.
- Applicazioni industriali: utilizzato nella produzione di ossido di magnesio e idrossido di magnesio, che vengono utilizzati come ritardanti di fiamma, nel trattamento delle acque reflue e come agente neutralizzante nei terreni acidi.
- Ricerca di laboratorio: utilizzato in vari esperimenti e ricerche di laboratorio, come la preparazione di soluzioni standard e il test di procedure analitiche.
Domande:
D: Il Mg(NO3)2 è solubile?
R: Sì, il nitrato di magnesio è molto solubile in acqua.
D: Qual è la formula del nitrato di magnesio?
R: La formula del nitrato di magnesio è Mg(NO3)2.
D: Qual è la massa molare di Mg(NO3)2?
R: La massa molare di Mg(NO3)2 è 148,31 g/mol.
D: Qual è il peso formula di Mg(NO3)2?
R: Il peso della formula di Mg(NO3)2 è 148,31 g/mol.
D: Qual è il nome sistematico di Mg(NO3)2?
R: Il nome sistematico per Mg(NO3)2 è dinitrato di magnesio.
D: Qual è la concentrazione di ioni nitrato in una soluzione 0,125 M Mg(NO3)2?
R: La concentrazione di ioni nitrato in una soluzione di Mg(NO3)2 da 0,125 M è 0,25 M, perché ci sono due ioni nitrato per ogni ione magnesio.
D: Qual è la massa formula di Mg(NO3)2?
R: La massa formula di Mg(NO3)2 è 148,31 g/mol.
