Il carbonato di calcio è un composto chimico con la formula CaCO3. Si trova comunemente nelle rocce e nelle conchiglie e viene utilizzato nella produzione di cemento, vernici e integratori alimentari.
| Nome IUPAC | Carbonato di calcio |
| Formula molecolare | CaCO3 |
| numero CAS | 471-34-1 |
| Sinonimi | Calcare, gesso, calcite, aragonite, marmo, carbonato di calcio precipitato, sale di calcio dell’acido carbonico (1:1) |
| InChI | InChI=1S/CH2O3.Ca/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
CaCO3 Massa molare
La massa molare del carbonato di calcio è 100,09 g/mol. Ciò significa che una mole di carbonato di calcio contiene 100,09 grammi del composto. La massa molare è importante nei calcoli stechiometrici perché consente la conversione da moli a grammi o viceversa.
Formula di carbonato di calcio
La formula chimica del carbonato di calcio è CaCO₃. Ciò significa che ciascuna molecola di carbonato di calcio contiene un atomo di calcio, un atomo di carbonio e tre atomi di ossigeno. La formula è importante per determinare la quantità di carbonato di calcio necessaria per un’applicazione specifica e per comprenderne le proprietà chimiche.
Punto di ebollizione del carbonato di calcio
Il carbonato di calcio non ha un punto di ebollizione perché si decompone prima di raggiungere il punto di ebollizione. A pressione atmosferica, il carbonato di calcio si decompone in ossido di calcio e anidride carbonica a temperature superiori a 825°C. Pertanto, il carbonato di calcio è comunemente utilizzato in applicazioni ad alta temperatura, come nella produzione di cemento.
Punto di fusione del carbonato di calcio
Il punto di fusione del carbonato di calcio è 1339°C. A questa temperatura, il carbonato di calcio subisce una decomposizione termica per formare ossido di calcio e anidride carbonica. Il punto di fusione è importante per comprendere il comportamento del carbonato di calcio alle alte temperature.
Densità del Carbonato di Calcio g/ml
La densità del carbonato di calcio è 2,71 g/cm³. Ciò significa che il carbonato di calcio è più denso dell’acqua e affonderà se immerso nell’acqua. La densità è importante per comprendere le proprietà fisiche del carbonato di calcio e per determinarne gli usi in varie applicazioni.
Peso molecolare del carbonato di calcio
Il peso molecolare del carbonato di calcio è 100,09 g/mol. Ciò significa che il composto è costituito da un atomo di calcio, un atomo di carbonio e tre atomi di ossigeno. Il peso molecolare è importante per determinare la quantità di carbonato di calcio necessaria per un’applicazione specifica e per comprenderne le proprietà chimiche.
Struttura del carbonato di calcio
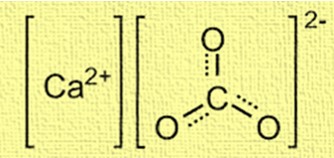
La struttura del carbonato di calcio è cristallina e composta da ioni calcio (Ca²⁺) e ioni carbonato (CO₃²⁻). Gli ioni calcio si trovano al centro della struttura e sono circondati da sei ioni carbonato. Gli ioni carbonato sono disposti in una forma planare trigonale, con ciascun atomo di ossigeno collegato all’atomo di carbonio tramite un doppio legame. La struttura è importante per comprendere il comportamento del carbonato di calcio in varie applicazioni, come la formazione di conchiglie e barriere coralline.
| Aspetto | Polvere bianca o cristallo incolore |
| Peso specifico | 2.71 |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 100,09 g/mole |
| Densità | 2,71 g/cm³ |
| Punto di fusione | 1339°C |
| Punto di ebollizione | Si rompe prima dell’ebollizione |
| Punto flash | Non applicabile |
| solubilità in acqua | 0,0013 g/100ml (25°C) |
| Solubilità | Insolubile in acqua e nella maggior parte dei solventi organici |
| Pressione del vapore | Trascurabile |
| Densità del vapore | Non applicabile |
| pKa | 9:00 (prima); 11,8 (secondo) |
| pH | 9,3 – 9,7 (soluzione acquosa 0,1 M) |
Sicurezza e pericoli del carbonato di calcio
Il carbonato di calcio è generalmente considerato sicuro per l’uomo e per l’ambiente se utilizzato come indicato. Tuttavia, l’inalazione della polvere di carbonato di calcio può causare irritazione alle vie respiratorie, agli occhi e alla pelle. L’esposizione a lungo termine ad alte concentrazioni di polvere di carbonato di calcio può causare danni ai polmoni. Il carbonato di calcio può anche reagire con acidi forti per produrre anidride carbonica, che in determinate situazioni può causare pericolo di incendio o esplosione. È importante seguire le corrette procedure di sicurezza quando si maneggia il carbonato di calcio, come indossare dispositivi di protezione e garantire un’adeguata ventilazione.
| Simboli di pericolo | Non applicabile |
| Descrizione della sicurezza | Evitare l’inalazione di polvere. Indossare dispositivi di protezione. |
| Numeri di identificazione delle Nazioni Unite | Non regolato |
| Codice SA | 2836.50.00 |
| Classe di pericolo | Non regolato |
| Gruppo di imballaggio | Non applicabile |
| Tossicità | Bassa tossicità per l’uomo e l’ambiente |
Metodi di sintesi del carbonato di calcio
Vari metodi possono sintetizzare il carbonato di calcio (CaCo3), inclusi i metodi di precipitazione, carbonatazione e sol-gel.
Il metodo di precipitazione prevede la miscelazione dell’idrossido di calcio con un sale di carbonato solubile, come il carbonato di sodio , in condizioni controllate per formare un precipitato CaCo3. Per ottenere il prodotto finale il precipitato deve essere filtrato ed essiccato.
Il metodo della carbonatazione prevede la reazione dell’ossido di calcio con l’anidride carbonica ad alta pressione e temperatura per produrre CaCo3. La reazione deve essere condotta in un sistema chiuso per impedire la fuoriuscita di anidride carbonica. Successivamente, qualsiasi ossido di calcio o anidride carbonica non reagito deve essere separato dal CaCo3 risultante e purificato.
Il metodo sol-gel prevede l’idrolisi e la condensazione di un precursore contenente calcio, come l’alcossido di calcio o il nitrato di calcio, in presenza di un solvente e di un catalizzatore. Per produrre CaCo3, il gel ottenuto deve essere essiccato e calcinato.
Il metodo di sintesi del CaCo3 prevede l’uso della biomineralizzazione, in cui organismi viventi come coralli o gusci di ostriche generano cristalli di CaCo3. Gli operatori raccolgono questi cristalli e li lavorano per ottenere il prodotto finale.
Ciascun metodo presenta vantaggi e svantaggi e la scelta del metodo dipende da fattori quali costo, purezza e dimensione delle particelle desiderata del prodotto finale.
Usi del carbonato di calcio
Il carbonato di calcio ha molti usi in vari settori, grazie alle sue proprietà come bassa tossicità, elevata purezza e disponibilità a basso costo. Alcuni usi comuni del carbonato di calcio sono:
- Costruzione: utilizzato come materiale da costruzione sotto forma di pietra calcarea, marmo e gesso. Utilizzato come riempitivo per migliorare la resistenza e la durabilità di cemento, malta e calcestruzzo.
- Prodotti farmaceutici: utilizzati nella produzione di antiacidi e integratori di calcio. Utilizzato come eccipiente nella formulazione di compresse e capsule.
- Alimenti e bevande: utilizzato come additivo alimentare per fortificare il calcio e come regolatore del pH nelle bevande.
- Carta e pasta di legno: utilizzati come riempitivo e agente di rivestimento nella produzione di carta e cartone, per migliorare la stampabilità e il punto di bianco.
- Materie plastiche: utilizzate come riempitivo e rinforzo nei prodotti in plastica, per migliorarne le proprietà meccaniche e ridurre i costi.
- Vernici e rivestimenti: utilizzati come pigmento e riempitivo in vernici e rivestimenti, per migliorarne l’opacità e la copertura.
- Agricoltura: utilizzato come ammendante per migliorare la qualità del suolo e la crescita delle colture.
- Trattamento dell’acqua: utilizzato per neutralizzare l’acqua acida e rimuovere le impurità dall’acqua.
Questi sono alcuni degli usi più comuni del carbonato di calcio, ma esistono molte altre applicazioni in vari settori.
Domande:
D: Il carbonato di calcio è solubile in acqua?
R: Il carbonato di calcio ha una bassa solubilità in acqua, con una solubilità di circa 0,0013 g/100 mL a 25°C.
D: Cos’è il carbonato di calcio?
R: Il carbonato di calcio è un composto chimico con la formula CaCO3. È una sostanza comune che si trova nelle rocce, nei gusci degli organismi marini e in vari depositi minerali.
D: Dove puoi trovare il carbonato di calcio?
R: Il carbonato di calcio può essere trovato in varie fonti naturali come calcare, gesso e marmo. Si trova anche nei gusci di organismi marini come ostriche, vongole e coralli.
D: Il carbonato di calcio è ionico o covalente?
R: Il carbonato di calcio è un composto ionico composto da un catione di calcio (Ca2+) e un anione carbonato (CO32-).
D: Il carbonato di calcio è un tipo di sedimento idrogenato che può essere sepolto e indurito in _____.
R: Il carbonato di calcio è un tipo di sedimento idrogenato che può essere sepolto e indurito nel calcare.
D: Le strutture stratificate costituite da carbonato di calcio dai cianobatteri precambriani sono chiamate _____.
R: Le strutture stratificate costituite da carbonato di calcio dai cianobatteri precambriani sono chiamate stromatoliti.
