Il cloruro rameoso o cloruro di rame (I) è un composto con la formula chimica CuCl, composto da un atomo di rame e un atomo di cloro. È un solido bianco con struttura cristallina e viene utilizzato in diverse applicazioni industriali, come catalizzatore e nella produzione di altri composti del rame.
| Nome IUPAC | Cloruro di rame(I). |
| Formula molecolare | CuCl |
| numero CAS | 7758-89-6 |
| Sinonimi | Monocloruro rameoso, cloruro di rame (CuCl), cloruro di rame (I), cloruro rameico, Nantokite |
| InChI | InChI=1S/ClH.Cu/h1H;/q;+1/p-1 |
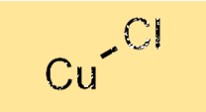
Formula del cloruro di rame(I).
La formula del cloruro di rame(I) è CuCl. Ciò indica che ciascuna molecola di cloruro di rame (I) contiene un atomo di rame e un atomo di cloro. La formula può essere utilizzata per calcolare la massa di un campione di cloruro di rame(I) o il numero di moli di cloruro di rame(I) presenti in un campione. La formula fornisce anche informazioni sul numero relativo di atomi presenti nel composto, utili per comprenderne proprietà e comportamento.
Massa molare del cloruro di rame(I).
La massa molare del cloruro di rame (I) è la massa di una mole del composto. Si calcola sommando le masse atomiche degli elementi che compongono il composto. Il cloruro di rame(I) ha una massa molare di 98,99 g/mol. Questo valore può essere utilizzato per convertire tra la massa di un campione di cloruro di rame(I) e il numero di moli presenti nel campione.
Punto di ebollizione del cloruro di rame(I).
Il punto di ebollizione del cloruro di rame (I) è la temperatura alla quale il composto passa da liquido a gas. Il cloruro di rame(I) ha un punto di ebollizione relativamente basso di 1.490°C. Ciò è dovuto alle deboli forze intermolecolari tra le molecole di cloruro di rame (I). A questa temperatura, le molecole acquistano energia cinetica sufficiente per superare le forze attrattive che le tengono insieme in forma liquida.
Punto di fusione del cloruro di rame(I).
Il punto di fusione del cloruro di rame (I) è la temperatura alla quale il composto passa da solido a liquido. Il cloruro di rame(I) ha un punto di fusione relativamente alto di 430°C. Ciò è dovuto ai forti legami ionici tra gli atomi di rame e cloro che compongono il composto. A questa temperatura l’energia termica fornita al composto è sufficiente per rompere i legami ionici e consentire agli atomi di muoversi liberamente in forma liquida.
Densità del cloruro di rame(I) g/ml
La densità del cloruro di rame(I) è una misura della sua massa per unità di volume. Il cloruro di rame(I) ha una densità di 4,14 g/mL a temperatura ambiente. Questo valore indica che il cloruro di rame (I) è una sostanza densa e scorrerà in liquidi meno densi di lui.
Peso molecolare del cloruro di rame (I).
Il peso molecolare del cloruro di rame (I) è la somma dei pesi atomici degli atomi in una singola molecola del composto. Il cloruro di rame(I) ha un peso molecolare di 98,99 g/mol. Questo valore può essere utilizzato per convertire tra la massa di un campione di cloruro di rame(I) e il numero di molecole presenti nel campione.
Struttura del cloruro di rame(I).
Il cloruro di rame (I) ha una struttura cristallina in cui gli atomi di rame sono circondati da quattro atomi di cloro in una disposizione tetraedrica. Gli atomi di rame sono collegati agli atomi di cloro tramite legami ionici, che risultano dal trasferimento di elettroni dagli atomi di rame agli atomi di cloro. Questa struttura conferisce al cloruro di rame (I) le sue proprietà caratteristiche, come l’elevato punto di fusione e la densità.
| Aspetto | Polvere cristallina bianca |
| Peso specifico | 4,14 g/cm³ |
| Colore | Bianco |
| Odore | Inodore |
| Massa molare | 98,99 g/mole |
| Densità | 4,14 g/cm³ |
| Punto di fusione | 430°C |
| Punto di ebollizione | 1490°C |
| Punto flash | Non applicabile |
| solubilità in acqua | 0,0095 g/l a 20°C |
| Solubilità | Solubile in acido cloridrico concentrato, ammoniaca e cianuro di potassio. Insolubile in etanolo ed etere. |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| pKa | Non applicabile |
| pH | 4,6 – 5,8 (soluzione all’1%) |
Sicurezza e pericoli del cloruro rameoso
Il cloruro rameoso comporta numerosi rischi per la sicurezza e la salute. È nocivo se ingerito e può causare irritazioni agli occhi, alla pelle e alle vie respiratorie. Il cloruro rameoso può anche causare febbre da fumi metallici, una condizione caratterizzata da sintomi simil-influenzali come febbre, brividi e tosse. L’esposizione a lungo termine al cloruro rameoso può causare danni ai polmoni e altri effetti cronici sulla salute. Quando si maneggia il cloruro rameoso, è importante indossare indumenti protettivi, guanti e protezioni per gli occhi per ridurre al minimo il rischio di esposizione. In caso di ingestione o esposizione accidentale consultare immediatamente un medico. La corretta manipolazione, stoccaggio e smaltimento del cloruro rameoso sono necessari per prevenire la contaminazione ambientale e danni alla salute umana.
| Simboli di pericolo | Teschio e ossa incrociate |
| Descrizione della sicurezza | Non ingerire. Indossare indumenti protettivi, guanti e protezione per gli occhi. In caso di ingestione o esposizione, consultare immediatamente un medico. Sono necessari un trattamento, uno stoccaggio e uno smaltimento adeguati. |
| Numeri di identificazione delle Nazioni Unite | ONU 3077 |
| Codice SA | 28273910 |
| Classe di pericolo | 6.1 |
| Gruppo di imballaggio | II |
| Tossicità | Tossico se ingerito o inalato. Provoca irritazione alla pelle e agli occhi. Può causare danni ai polmoni e altri effetti cronici sulla salute. |
Metodi per la sintesi del cloruro rameoso
Esistono diversi metodi per sintetizzare il cloruro rameoso:
Un metodo comune prevede la reazione tra rame e acido cloridrico. Il rame metallico reagisce con l’acido cloridrico per produrre CuCl e idrogeno gassoso. CuCl può essere purificato mediante filtrazione ed essiccazione.
Un altro metodo prevede la reazione tra ossido di rame e acido cloridrico.
Per sintetizzare il cloruro rameoso, l’ossido di rame può essere aggiunto a una soluzione di acido cloridrico per produrre CuCl2. Successivamente, è possibile utilizzare un agente riducente come acido cloridrico o anidride solforosa per ridurre CuCl2 per formare CuCl.
Un altro metodo per sintetizzare CuCl prevede la dissoluzione del solfato di rame e del cloruro di sodio in acqua, il riscaldamento della soluzione risultante e la filtrazione per rimuovere le impurità. Dopo aver filtrato la soluzione ottenuta è possibile raffreddarla fino a formare cristalli di CuCl.
Una variante di questo metodo prevede la reazione tra solfato di rame e cloruro di sodio in presenza di agenti riducenti come acido ascorbico o glucosio. L’agente riducente riduce gli ioni Cu2+ nel solfato di rame in ioni Cu+, che poi reagiscono con gli ioni cloruro nel cloruro di sodio per formare CuCl.
Nel complesso, questi metodi offrono una gamma di opzioni per la sintesi del cloruro rameoso, con variazioni a seconda delle materie prime e delle condizioni utilizzate. È necessaria un’attenta attenzione alla sicurezza e alle considerazioni ambientali durante la sintesi e la manipolazione del cloruro rameoso.
Usi del cloruro rameoso
Il cloruro rameoso ha numerose applicazioni in vari campi. Ecco alcuni usi comuni del cloruro rameoso:
- Catalisi: utilizzato come catalizzatore in varie reazioni chimiche, inclusa la sintesi di composti organici come prodotti farmaceutici e agrochimici.
- Pigmento: utilizzato come pigmento nell’industria della ceramica e del vetro. Conferisce un colore verde ai prodotti.
- Agente antivegetativo: utilizzato come agente antivegetativo in applicazioni marine per prevenire la crescita di cirripedi, alghe e altri organismi marini su navi e imbarcazioni.
- Fotografia: utilizzato come sviluppatore fotografico per produrre immagini in bianco e nero. Viene utilizzato come agente riducente per convertire gli ioni d’argento in argento metallico.
- Galvanotecnica: utilizzata nella galvanica per depositare uno strato di rame su un substrato. Viene utilizzato nella produzione di componenti elettronici, gioielli e altri prodotti.
- Fungicida: utilizzato come fungicida per proteggere le piante dalle malattie fungine.
- Saldatura: utilizzata nella saldatura per rimuovere gli strati di ossido dalle superfici metalliche prima della saldatura.
- Incisione: utilizzato come agente di incisione nella produzione di circuiti stampati e altri componenti elettronici.
Il cloruro rameoso è ampiamente utilizzato in vari settori grazie alle sue proprietà distintive. Le industrie lo utilizzano in varie applicazioni che vanno dalla catalisi ai rivestimenti marini.
Domande:
D: CuCl è solubile in acqua?
R: Sì, CuCl è leggermente solubile in acqua, con una solubilità di circa 0,67 g/L a temperatura ambiente.
D: CuCl è solubile?
R: CuCl è leggermente solubile in acqua, ma insolubile in solventi organici come etanolo ed etere.
D: Qual è il nome di CuCl?
A: Il nome di CuCl è cloruro rameoso.
D: Cosa provoca la formazione di bolle quando l’alluminio viene posto in una soluzione di CuCl? R: Quando l’alluminio viene posto in una soluzione CuCl, si verifica una reazione redox, in cui l’alluminio riduce gli ioni Cu2+ in CuCl in ioni Cu+, formando cloruro di alluminio (AlCl3) e rame metallico (Cu). Le bolle osservate sono gas idrogeno (H2) prodotto come sottoprodotto della reazione tra l’alluminio e le molecole di acqua presenti nella soluzione.
