L’acido clorico (HClO3) è un acido forte e instabile che può essere prodotto mescolando il biossido di cloro con acqua. Viene utilizzato negli agenti sbiancanti e disinfettanti, nonché nella produzione di esplosivi.
| Nome IUPAC | Acido clorico |
| Formula molecolare | HClO3 |
| numero CAS | 7790-93-4 |
| Sinonimi | Acido perclorico, clorato; Soluzione di acido clorico; Acido clorico (V); Clorato di idrogeno; Triclorato di idrogeno |
| InChI | InChI=1S/ClHO3/c2-1(3)4/h(H,2,3,4) |
Le proprietà dell’acido clorico (HClO3) sono di particolare interesse per chimici e ingegneri a causa delle sue numerose applicazioni industriali.
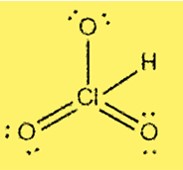
Struttura di Lewis HClO3
La struttura di Lewis dell’HClO3 mostra che il cloro è l’atomo centrale legato a tre atomi di ossigeno e un atomo di idrogeno. Il cloro ha 7 elettroni di valenza e ogni ossigeno ha 6 elettroni di valenza. La struttura comprende tre legami singoli e un doppio legame tra atomi di cloro e ossigeno.
Formula dell’acido clorico (HClO3).
La formula chimica dell’acido clorico (HClO3) è HClO3. È un acido inorganico che contiene un atomo di cloro, un atomo di idrogeno e tre atomi di ossigeno. La formula dell’acido clorico (HClO3) viene utilizzata per calcolare la stechiometria e la concentrazione delle soluzioni contenenti l’acido.
Massa molare dell’acido clorico (HClO3).
La massa molare dell’acido clorico (HClO3) è 84,46 g/mol. È un acido relativamente leggero rispetto ad altri acidi inorganici, come l’acido solforico, che ha una massa molare di 98,08 g/mol. La massa molare dell’acido clorico (HClO3) è un parametro importante nel calcolo della concentrazione e della stechiometria delle soluzioni contenenti l’acido.
Punto di ebollizione dell’acido clorico (HClO3)
L’acido clorico (HClO3) ha un punto di ebollizione di 40,5°C. È un acido molto volatile che può decomporsi ad alte temperature, rendendolo difficile da maneggiare e conservare. Il basso punto di ebollizione dell’acido clorico (HClO3) è una considerazione importante nella progettazione di apparecchiature e processi che comportano l’uso dell’acido.
Punto di fusione dell’acido clorico (HClO3)
L’acido clorico (HClO3) non ha un punto di fusione ben definito. Può decomporsi prima di raggiungere il punto di fusione, rilasciando gas ossigeno e lasciando dietro di sé un residuo di clorati. La mancanza di un punto di fusione distinto è dovuta all’instabilità dell’acido clorico (HClO3).
Densità dell’acido clorico (HClO3) g/ml
La densità dell’acido clorico (HClO3) è 1,97 g/cm³. È un acido relativamente denso rispetto ad altri acidi inorganici, come l’acido cloridrico, che ha una densità di 1,18 g/cm³. L’elevata densità dell’acido clorico (HClO3) è una considerazione importante nella progettazione di processi che coinvolgono la manipolazione e il trasporto dell’acido.
Peso molecolare dell’acido clorico (HClO3)
Il peso molecolare dell’acido clorico (HClO3) è 84,46 g/mol. È la somma dei pesi atomici dei suoi elementi costitutivi: un atomo di cloro, un atomo di idrogeno e tre atomi di ossigeno. Il peso molecolare dell’acido clorico (HClO3) è un parametro importante nel calcolo della concentrazione e della stechiometria delle soluzioni contenenti l’acido.
Struttura dell’acido clorico (HClO3)
La struttura dell’acido clorico è composta da un atomo centrale di cloro legato a tre atomi di ossigeno e un atomo di idrogeno. La molecola ha una geometria tetraedrica, con l’atomo di cloro al centro del tetraedro. I tre atomi di ossigeno sono disposti attorno all’atomo di cloro in una disposizione planare trigonale, mentre l’atomo di idrogeno è legato a uno degli atomi di ossigeno. La struttura dell’acido clorico (HClO3) è importante per comprenderne le proprietà chimiche e la reattività.
| Aspetto | Liquido limpido o giallastro |
| Peso specifico | 1,97 |
| Colore | Da incolore a giallo |
| Odore | Inodore |
| Massa molare | 84,46 g/mole |
| Densità | 1,68 g/cm³ |
| Punto di fusione | Si decompone prima di sciogliersi |
| Punto di ebollizione | 40,5°C |
| Punto flash | Non applicabile |
| solubilità in acqua | Miscibile |
| Solubilità | Solubile nella maggior parte dei solventi organici |
| Pressione del vapore | Non applicabile |
| Densità del vapore | Non applicabile |
| PKa | -0,6 |
| PH | <1 |
Acido clorico (HClO3) Sicurezza e pericoli
L’acido clorico (HClO3) presenta diversi rischi per la sicurezza e deve essere maneggiato con cura. È un forte ossidante che può reagire violentemente con molti materiali organici, inclusi carburanti, agenti riducenti e liquidi infiammabili. Può causare gravi ustioni alla pelle e agli occhi a contatto e può essere corrosivo per le superfici metalliche. L’inalazione dei suoi vapori può causare irritazione respiratoria e tosse. A causa della sua natura reattiva, deve essere conservato e maneggiato in un’area ben ventilata, lontano da altri prodotti chimici. Quando si maneggia l’acido clorico è necessario indossare dispositivi di protezione, come guanti, occhiali e un respiratore, per evitare l’esposizione. In caso di contatto con la pelle o con gli occhi, è necessario consultare immediatamente un medico.
| Simboli di pericolo | Agente ossidante |
| Descrizione della sicurezza | Evitare il contatto con la pelle e gli occhi; indossare dispositivi di protezione |
| Identificatori AN | ONU 3084 |
| Codice SA | 2811.19 |
| Classe di pericolo | 5.1 |
| Gruppo di imballaggio | II |
| Tossicità | Corrosivo; può causare gravi ustioni alla pelle e agli occhi |
Metodi per la sintesi dell’acido clorico (HClO3)
L’acido clorico può essere sintetizzato con diversi metodi, inclusa la reazione del cloro gassoso con idrossido di sodio o clorato di sodio. Un metodo comune è la reazione del clorato di sodio con acido cloridrico.
La reazione di sintesi dell’acido clorico prevede la reazione del clorato di sodio (NaClO3) con l’acido cloridrico (HCl) in un processo in due fasi. La prima fase prevede la conversione del clorato di sodio in clorito di sodio (NaClO2) e biossido di cloro (ClO2) gassoso in presenza di un catalizzatore acido. Nella seconda fase, il biossido di cloro gassoso reagisce con l’acido cloridrico in eccesso per formare acido clorico e cloro gassoso.
Un altro metodo per sintetizzare l’acido clorico prevede l’elettrolisi di una soluzione contenente cloruro di sodio, acido nitrico e acido solforico. Questo processo produce cloro gassoso che reagisce con l’acqua per formare acido clorico.
Per produrre acido clorico, il clorato di potassio può essere fatto reagire con acido solforico e quindi la miscela ottenuta viene distillata.
La sintesi dell’acido clorico richiede un’attenta manipolazione dei reagenti a causa del rischio di reazioni violente e della natura corrosiva degli acidi coinvolti. È importante seguire protocolli di sicurezza adeguati e maneggiare i materiali in un’area ben ventilata utilizzando dispositivi di protezione adeguati.
Usi dell’acido clorico (HClO3)
L’acido clorico (HClO3) ha diverse applicazioni in vari settori grazie alle sue forti proprietà ossidanti. Alcuni dei suoi usi sono:
- Produzione di altri prodotti chimici: l’acido clorico funge da intermedio nella produzione di altri prodotti chimici, tra cui acido perclorico, clorati e perclorati.
- Agente sbiancante: l’industria della pasta di legno e della carta utilizza l’acido clorico come agente sbiancante.
- Disinfettante: l’acido clorico agisce come disinfettante nell’industria alimentare e delle bevande per disinfettare attrezzature e superfici.
- Mordenzante: l’industria dei semiconduttori utilizza l’acido clorico come mordenzante per rimuovere strati di materiale indesiderati dai wafer semiconduttori.
- Reagente di laboratorio: l’acido clorico viene utilizzato come reagente di laboratorio in chimica analitica e sintesi organica.
- Agente ossidante: L’acido clorico è utilizzato come agente ossidante nelle reazioni di chimica organica.
- Propellente per razzi: l’acido clorico funge da ossidante nei propellenti per razzi.
- Trattamento dell’acqua: l’acido clorico viene utilizzato nel trattamento dell’acqua per controllare la crescita di alghe e batteri.
Domande:
D: L’acido clorico è un acido forte?
R: Sì, l’acido clorico (HClO3) è un acido forte.
D: Quale formula rappresenta l’acido clorico?
R: La formula dell’acido clorico è HClO3.
D: Spiega perché HCl è acido cloridrico e HClO3 è acido clorico?
R: I nomi degli acidi binari (composti che contengono solo due elementi) derivano solitamente dal nome dell’anione, con il suffisso -ic per l’anione più comune e -ous per quello meno comune. Nel caso dell’HCl, l’anione è cloruro (Cl-), quindi l’acido è chiamato acido cloridrico. Nel caso di HClO3, l’anione è clorato (ClO3-), quindi l’acido è chiamato acido clorico.
D: Qual è la formula dell’acido clorico?
R: La formula dell’acido clorico è HClO3.
D: L’acido clorico è ionico o molecolare?
R: L’acido clorico è molecolare perché è costituito da atomi di idrogeno, cloro e ossigeno legati in modo covalente.
